(2024·江苏盐城高一开学考试)亚硫酸可被H2O2氧化生成硫酸:H2SO3+H2O2![]() H2SO4+H2O。下列说法不正确的是( )
H2SO4+H2O。下列说法不正确的是( )
- A: H2O2中O的化合价:-1
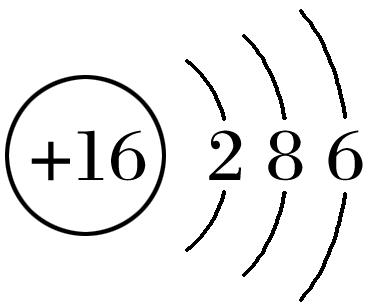
- B: 硫原子结构示意图:
- C: H2SO4是离子化合物
- D: 硫酸电离:H2SO4
 2H++S
2H++S
(2024·江苏盐城高一开学考试)亚硫酸可被H2O2氧化生成硫酸:H2SO3+H2O2![]() H2SO4+H2O。下列说法不正确的是( )
H2SO4+H2O。下列说法不正确的是( )

(2024·河南信阳高一期末)铟(In)被称为信息产业中的“朝阳元素”。如图是铟元素的相关信息,下列说法错误的是( )

(2024·北京怀柔区高一开学考试)下列有关物质的性质比较,错误的是( )
鸟粪石[化学式为Mg(NH4)PO4·6H2O]是一种盛产于秘鲁的优质氮磷肥料;钴(Co)是质子数为27的元素,它的中子数为33的核素可用于癌症的放射性治疗。下列有关说法正确的是( )
①钴不是主族元素 ②CoCl2不能长期稳定地存在 ③鸟粪石中金属阳离子的结构示意图为![]() ④鸟粪石中2种阳离子的电子式分别为
④鸟粪石中2种阳离子的电子式分别为![]() 、
、![]()
解析:
钴属于过渡元素,不属于主族元素,故①正确;Co具有放射性,放置过程中会发生衰变,故②正确;鸟粪石中的金属阳离子为Mg2+,结构示意图为![]() ,③正确;简单阳离子的电子式与离子符号相同,④错误。
,③正确;简单阳离子的电子式与离子符号相同,④错误。
(2024·湖北枝江高一段考)下列关于锂、镁、铁、铝的说法正确的是( )
解析:
Li在空气中加热生成Li2O,A错误;常温下镁和水反应缓慢,不能剧烈反应,B错误;铝能溶于氢氧化钠溶液,铁粉中含有少量的Al,可加入NaOH溶液过滤除去,C正确;铝的化学性质很活泼,但其表面容易形成一层致密的氧化铝薄膜,其在空气中不易锈蚀,D错误。
(2024·深圳高一期末)已知反应NH3+HCl![]() NH4Cl,下列说法正确的是( )
NH4Cl,下列说法正确的是( )
解析:
氯化铵是离子化合物,既含离子键又含共价键,则该反应涉及极性共价键的断裂和离子键、极性共价键的生成,B错误;由非金属元素组成的化合物不一定是共价化合物,如氯化铵,C错误;用电子式表示HCl的形成为![]() ,D错误。
,D错误。
下列有关元素金属性或非金属性比较的说法不正确的是( )
如图所示实验可证明元素的非金属性:Cl>C>Si
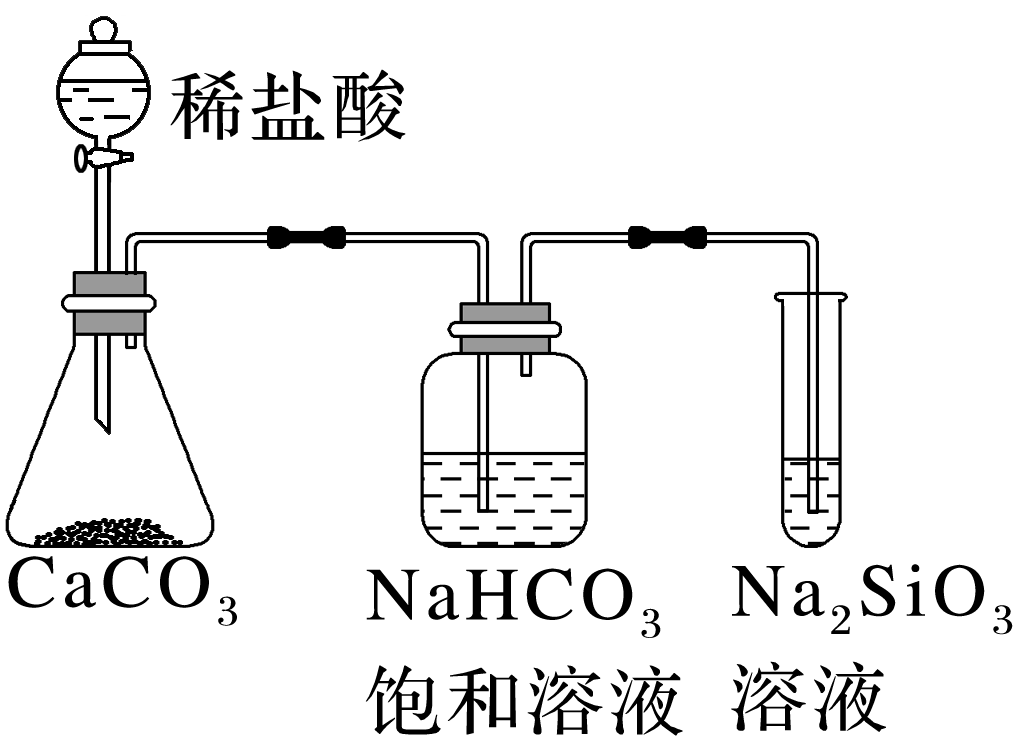
解析:
元素的金属性越强,与水反应越剧烈,将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液,可观察到加入镁带的试管变红,铝片无现象,可证明镁的金属性强,故A正确;非金属单质与氢气化合越容易,元素的非金属性越强,氟气与氢气化合较氧气更容易,则氟元素的非金属性较氧元素更强,故B正确;制取钾的反应Na+KCl![]() NaCl+K是利用了金属钾的熔、沸点比钠更低来进行的,和Na、K的金属性无关,不能说明Na的金属性比K强,故C正确;元素的非金属性越强,最高价含氧酸的酸性越强,由于HCl不是氯元素的最高价含氧酸,则此实验不能证明元素的非金属性:Cl>C,故D错误。
NaCl+K是利用了金属钾的熔、沸点比钠更低来进行的,和Na、K的金属性无关,不能说明Na的金属性比K强,故C正确;元素的非金属性越强,最高价含氧酸的酸性越强,由于HCl不是氯元素的最高价含氧酸,则此实验不能证明元素的非金属性:Cl>C,故D错误。
(2024·河南濮阳高一检测)下列关于元素周期表的说法中,正确的是( )
根据元素周期律,由下列事实进行归纳推测,推测不合理的是( )
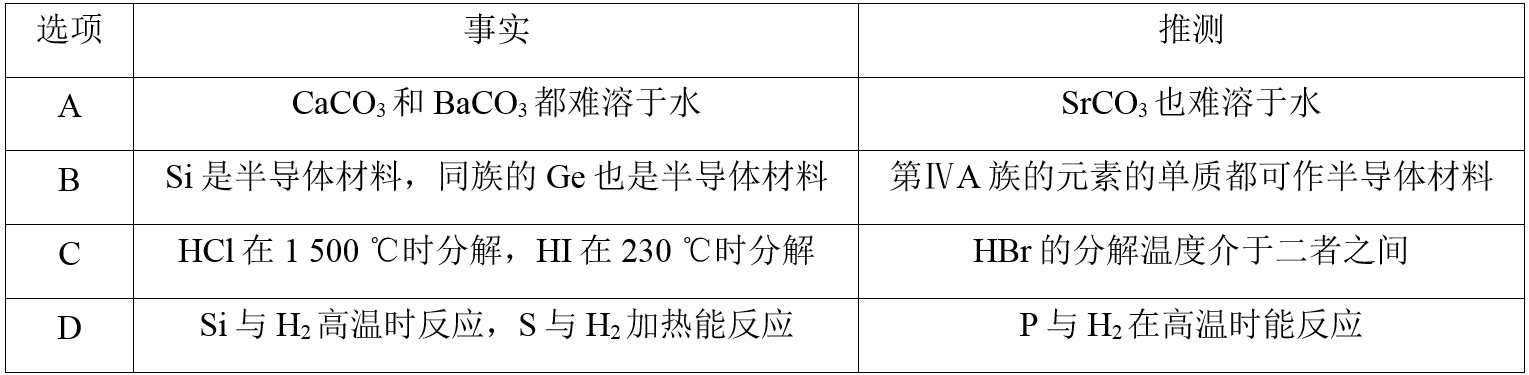
解析:
同一主族元素的性质相似,CaCO3和BaCO3都难溶于水,因此SrCO3也难溶于水,A项正确;在元素周期表中,位于金属和非金属分界线附近的元素的单质能作半导体材料,Pb不位于金属元素和非金属元素分界线附近,所以Pb不能作半导体材料,B项错误;元素的非金属性越强,其氢化物的稳定性越强,非金属性:Cl>Br>I,所以氢化物的稳定性:HCl>HBr>HI,则HBr的分解温度介于二者之间,C项正确;元素的非金属性越强,其单质与氢气反应越容易,非金属性:S>P>Si,所以P与H2在高温时能反应,D项正确。
(2024·无锡高一下开学考试)下列有关说法不正确的是( )
解析:
HCl溶于水破坏共价键,故选B。
(2024·合肥高一期末)类推的思维方式在化学学习与研究中经常采用,但类推出的结论是否正确要经过实验的验证。以下类推的结论正确的是( )
(2024·甘肃陇南高一段考)下列有关锂及其化合物的叙述中,不正确的是( )
解析:
Na与N2化合生成Na3N(氮化钠),则Li与N2化合生成Li3N(氮化锂),故选B。
(2024·哈尔滨高一期末)某学者绘制了一种八角星元素周期表,每个八角星代表一个周期(第一周期除外),每个“·”代表一种元素,“┈”代表同族元素相连。X、Y、Z、R、M为原子半径依次减小的五种短周期主族元素,Y的最外层电子数比最内层电子数多一个,下列说法正确的是( )
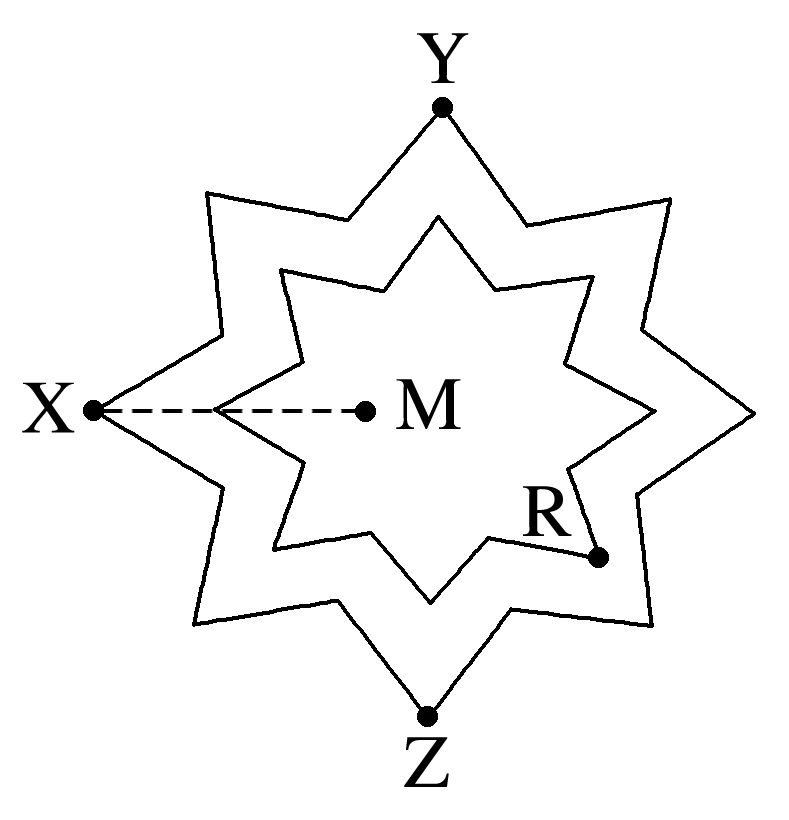
解析:
Y的最外层电子数比最内层电子数多一个,且位于第三周期,所以Y为Al;M位于第一周期,M为H元素;根据八角星的结构,X为Na,Z为Cl,R为O。原子序数:Z(Cl)>Y(Al)>X(Na),A错误;Z与M形成的化合物是HCl,H原子没有满足8电子稳定结构,B错误;Na、Al、Cl最高价氧化物对应的水化物分别为NaOH、Al(OH)3、HClO4,Al(OH)3是两性氢氧化物,既可以和酸反应也可以和碱反应,则这三种物质之间均能两两反应,C正确;O、Na形成的两种常见化合物为Na2O和Na2O2,Na2O中含有Na+和O2-,Na2O2中含有Na+和,阴、阳离子个数比均为1∶2,D错误。
“神舟十三号”飞船所使用的砷化镓太阳能电池是我国自主研发、自主生产的产品,拥有全部知识产权。砷(As)和镓(Ga)都位于第四周期,分别位于第ⅤA族和第ⅢA族。下列说法不正确的是( )
解析:
同周期元素自左到右原子半径逐渐减小,Ga和As位于同一周期,原子序数:As>Ga,原子半径:Ga>As,同主族元素自上到下原子半径逐渐增大,As在P的下一周期,原子半径:As>P,所以原子半径:Ga>As>P,A正确;同主族元素自上到下非金属性减弱,非金属性:N>P>As,非金属性越强,简单气态氢化物越稳定,所以热稳定性:NH3>PH3>AsH3,B正确;同周期元素自左到右非金属性逐渐增强,非金属性:S>P,同主族元素自上而下非金属性逐渐减弱,非金属性:P>As,所以非金属性:S>P>As,所以酸性:H2SO4>H3PO4>H3AsO4,C错误;镓(Ga)是第四周期第ⅢA族元素,与Al同族,与Al具有相似的性质,氢氧化铝是两性氢氧化物,Ga的金属性虽然比Al强,但可能具有两性,D正确。
(2024·东莞高一检测)四种短周期元素的离子aXm+、bYn+、cZn-、dRm-,它们具有相同的电子层结构,若m>n,对下列叙述正确的是( )
①a-b=n-m ②元素的原子序数:a>b>c>d ③元素非金属性:Z>R ④最高价氧化物对应水化物的碱性:X>Y ⑤还原性:Rm->Zn- ⑥X一定可与冷水反应
解析:
四种短周期元素的离子aXm+、bYn+、cZn-和dRm-具有相同的电子层结构,则a-m=b-n=c+n=d+m,若m>n,则原子序数:a>b>c>d,结合离子所得电荷可知,X、Y为金属元素,Z、R为非金属元素,且X、Y位于Z和R的下一周期,即X、Y处于第三周期,Z、R处于第二周期,②③⑤正确。
科学家合成的一种化合物是很多表面涂层的重要成分,其结构如图所示,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,只有X、Y在同一周期。下列说法错误的是 ( )
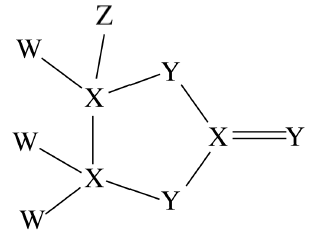
解析:
W、X、Y、Z均为短周期主族元素,且只有X、Y在同一周期,则根据元素周期表的结构,可知X、Y为第二周期元素,则W为H元素;如图,X形成4个共价键,Y形成2个共价键,Z形成1个共价键且为第三周期元素,则Z为Cl元素,X为C元素,Y为O元素。同周期元素原子半径从左到右依次减小,所以原子半径:C>O,故A正确;W为H元素,Y为O元素,其形成的化合物有H2O、H2O2,其中H2O2中存在极性键H—O和非极性键O—O,故B错误;W为H元素,X为C元素,Y为O元素,其形成的化合物H2CO3能与石灰水反应生成碳酸钙和水,使澄清石灰水变浑浊,故C正确;ClO2具有强氧化性,作为一种高效安全绿色杀菌剂,在自来水消毒等方面应用广泛,故D正确。
对于数以万计的化学物质和为数众多的化学反应,分类法的作用几乎是无可替代的。请利用分类法结合所学知识完成下列问题:
(1)现有9种微粒:H、H、C、C、N、Fe2+、Fe3+、O2、O3。形成上述9种微粒的核素有 种、元素有 种。以上微粒所含某些元素构成的五核10e-分子的空间结构是 ;写出一种由上述元素中的两种构成的含18e-的微粒的电子式: 。
(2)现有以下物质:①稀盐酸 ②Cl2 ③BaSO4固体 ④NaOH溶液 ⑤熔融NaHSO4 ⑥CO2 ⑦铝条 ⑧蔗糖。以上物质中能导电的是 (填序号,下同),属于电解质的是 ,属于非电解质的是 。
(3)已知有下列物质:①O2 ②NaCl ③CO2 ④H2O ⑤NH4Cl ⑥NaOH ⑦Na2O2。这些物质中,只含有离子键的是 (填序号,下同),含有非极性共价键的离子化合物是 ,属于共价化合物的是 ,用电子式表示H2O的形成过程: ,CO2的结构式为 。
答案: (1)7 5 正四面体形 (2)①④⑤⑦ ③⑤ ⑥⑧ (3)② ⑦ ③④ ![]() (答案合理即可)
(答案合理即可)![]() O
O![]() C
C![]() O
O
(2024·山东济宁高一段考)人体必需的一些元素在周期表中的分布情况如下:
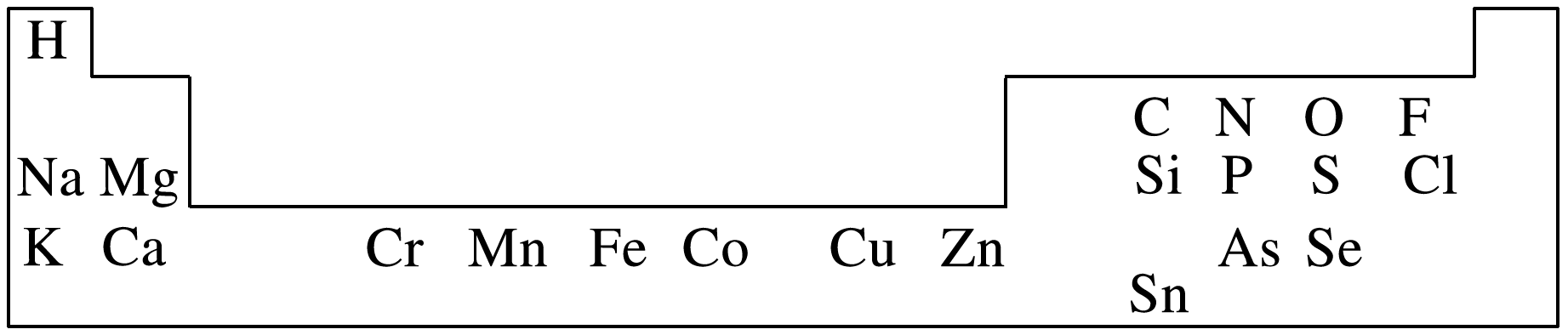
(1)碳、氢、氧、氮是人体内的主要元素。碳有多种同位素,其中考古时用于测定文物年代的是 。H2O2是一种绿色氧化剂,电子式为 。
(2)钠离子和氯离子可以帮助我们维持机体的电解质平衡。常温下,将Cl2通入水中,可以得到一种具有漂白性的分子,写出它的结构式: 。
(3)硒(Se)具有抗氧化、增强人体抵抗力的功效。Se原子序数为 ,在元素周期表中的位置是 。
(4)铁、铬、锰在人体内含量微乎其微,但对维持内分泌平衡和身体基础代谢有重要作用。向少量酸性H2O2溶液中加入FeSO4溶液,发生反应的离子方程式为 。
(5)前四周期同族元素的某种性质X随核电荷数的变化趋势如图所示,则下列说法正确的是 (填字母)。
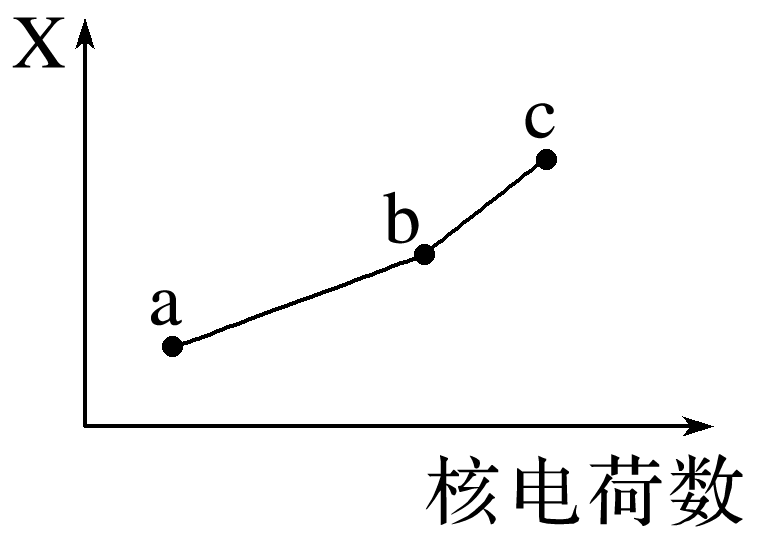
A.若a、b、c表示氧族元素,则X表示对应简单氢化物的沸点
B.若a、b、c表示卤族元素,则X表示对应简单离子的还原性
C.若a、b、c表示第 ⅠA族元素,则X表示对应离子的氧化性
D.若a、b、c表示第 ⅡA族元素,则X表示最高价氧化物对应水化物的碱性
答案: (1)14C (2)H—O—Cl (3)34 第四周期第ⅥA族 (4)2Fe2++H2O2+2H+ (5)BD![]()
![]() 2Fe3++2H2O
2Fe3++2H2O
解析:
(2)有漂白性的分子为次氯酸,其结构式为H—O—Cl。(3)Se为34号元素,位于元素周期表中第四周期第ⅥA族。(4)酸性条件下H2O2将Fe2+氧化为Fe3+,H2O2被还原为水。(5)氧族元素对应简单氢化物中水的沸点高于硫化氢,A错误;卤族元素随核电荷数增大,非金属性减弱,对应离子的还原性逐渐增强,B正确;第ⅠA族元素随核电荷数增大,金属性增强,对应离子的氧化性逐渐减弱,C错误;第ⅡA族元素,随核电荷数增大,金属性增强,最高价氧化物对应水化物的碱性逐渐增强,D正确。
A、B、C、D 4种短周期元素的原子序数依次增大。A、D同族,B、C同周期。A、B组成的化合物甲为气态,其中A、B原子个数之比为4∶1。常温下,由A、C组成的两种化合物乙和丙都为液态,乙中A、C原子个数之比为1∶1;丙中A、C原子个数之比为2∶1。由D和C组成的两种化合物丁和戊都为固态,丁中D、C原子个数之比为1∶1;戊中D、C原子个数之比为2∶1。B元素的最高价氧化物跟丁能发生化学反应,生成物为两种,其中一种为C的单质。
(1)写出对应物质的化学式:乙 ;丁 。
(2)B元素的最高价氧化物跟丁反应的化学方程式: 。
(3)写出下列物质的电子式:甲 ;戊 。
(4)A、B、C、D 4种元素的原子半径由大到小顺序为 (用元素符号表示)。
(5)由A、B、C、D 4种元素组成的既含离子键又含共价键的物质的化学式为 (写出一种即可)。
答案: (1)H2O2 Na2O2 (2)2CO2+2Na2O2 (3) (4)Na>C>O>H (5)NaHCO3(答案合理即可)![]() 2Na2CO3+O2
2Na2CO3+O2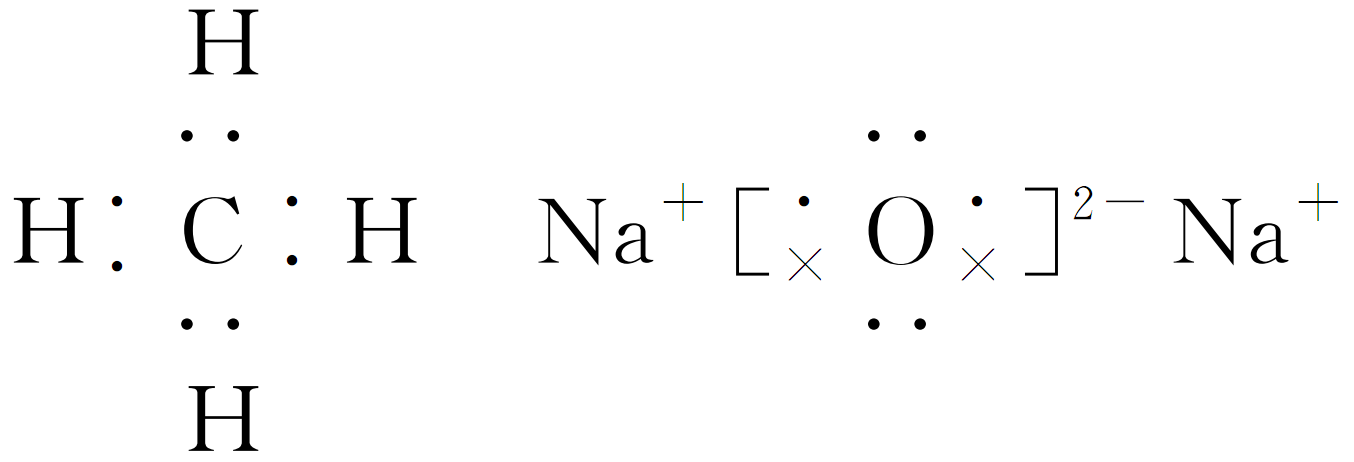
解析:
A、B、C、D 4种短周期元素,原子序数依次增大,A、B组成的化合物甲为气态,其中A、B的原子个数之比为4∶1,则甲为CH4,A是H元素、B是C元素;A、D同族,B的原子序数小于D,则D是Na元素;B、C同周期,由A、C组成的两种化合物乙、丙都是液态,这两种化合物是水和过氧化氢,乙中A、C原子个数之比为1∶1,丙中A、C原子个数之比为2∶1,则乙是H2O2、丙是H2O,C是O元素;由D、C组成的两种化合物丁和戊都是固体,为氧化钠和过氧化钠,丁中D、C原子个数之比为1∶1,戊中D、C原子个数之比为2∶1,则丁是Na2O2、戊是Na2O;总结:A为H,B为C,C为O,D为Na。(2)根据以上分析,B元素的最高价氧化物(CO2)跟丁(Na2O2)反应的化学方程式:2CO2+2Na2O2![]() 2Na2CO3+O2。
2Na2CO3+O2。
(2023·南昌高一检测)Ⅰ.某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
(1)将Na、K、Mg、Al各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果: (填元素符号,下同)与盐酸反应最剧烈, 与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明Cl的非金属性比S强,反应的离子方程式为 。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律。
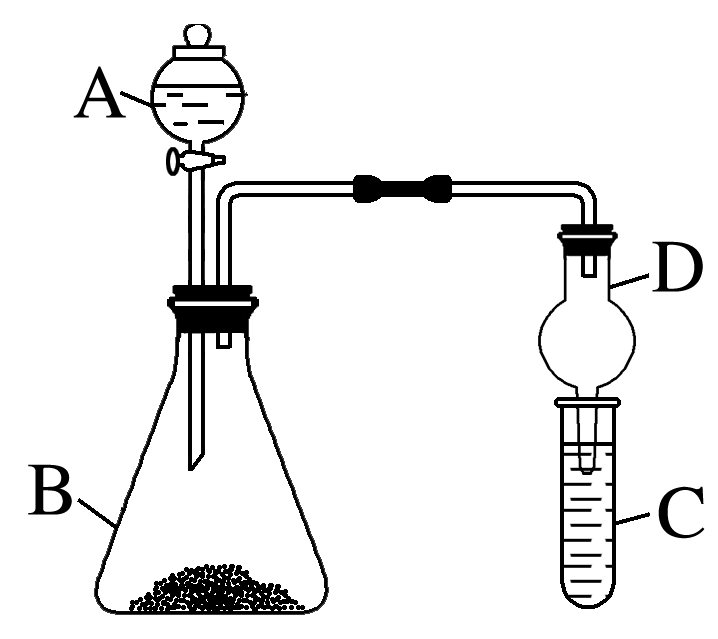
(3)仪器A的名称为 。
(4)实验室中现有药品:①稀盐酸、②稀硝酸、③Na2SiO3溶液、④Na2CO3固体,请选择合适药品设计实验验证N、C、Si的非金属性的变化规律;装置A、B中所装药品分别为 、 (填序号)。但有同学认为该装置有缺陷,如何改进? 。
Ⅲ.完成下列问题。
(5)铝是为数不多的能与强碱溶液反应的金属,请书写铝与氢氧化钠溶液反应的化学方程式: 。
(6)消除采矿业胶液中的氰化物(如KCN,C为+2价),经以下反应实现:KCN+H2O2+H2O![]() A+NH3↑(已配平)。则A的化学式: ,如此反应中有6.72 L(标准状况)气体生成,转移电子数目为 。
A+NH3↑(已配平)。则A的化学式: ,如此反应中有6.72 L(标准状况)气体生成,转移电子数目为 。
答案: (1)K Al (2)S2-+Cl2![]() 2Cl-+S↓ (3)分液漏斗 (4)② ④ 在B、D两装置间添加装有饱和碳酸氢钠溶液的洗气瓶,用来除去挥发出来的HNO3 (5)2Al+2NaOH+6H2O
2Cl-+S↓ (3)分液漏斗 (4)② ④ 在B、D两装置间添加装有饱和碳酸氢钠溶液的洗气瓶,用来除去挥发出来的HNO3 (5)2Al+2NaOH+6H2O![]() 2Na[Al(OH)4]+3H2↑ (6)KHCO3 0.6NA(或3.612×1023)
2Na[Al(OH)4]+3H2↑ (6)KHCO3 0.6NA(或3.612×1023)
解析:
(1)金属性由强到弱的顺序:钾>钠>镁>铝,所以相同条件下与盐酸反应最剧烈的是钾,反应速率最慢的是铝;生成1 mol氢气需要得到2 mol电子,1 mol钾、钠都失去1 mol电子,1 mol镁失去2 mol电子,而1 mol铝失去3 mol电子,所以生成氢气最多的是金属铝。(4)要证明非金属性:N>C>Si,则利用此装置证明最高价氧化物对应水化物(含氧酸)的酸性的强弱顺序为HNO3>H2CO3>H2SiO3,所以装置A、B中所装药品分别为②稀硝酸、④Na2CO3固体;因硝酸有挥发性,生成的CO2气体中混有硝酸蒸气,需要除去,否则会干扰碳酸与硅酸的强弱比较,需在B、D两装置间添加装有饱和碳酸氢钠溶液的洗气瓶,用来除去挥发出来的HNO3。(5)铝是为数不多的能与强碱溶液反应的金属,铝与氢氧化钠溶液反应生成四羟基合铝酸钠和氢气。(6)H2O2具有氧化性,将KCN中的C氧化为+4价,再根据质量守恒判断A的化学式为KHCO3;n(NH3)==0.3 mol,则转移的电子数为0.6NA。