第四章 智能作业5 元素周期表和元素周期律的应用
元素在周期表中的位置反映了元素的原子结构和元素的性质。下列说法正确的是( )
- A: 同一元素不可能既表现金属性,又表现非金属性
- B: 第三周期主族元素的最高正化合价等于它的主族序数
- C: 短周期元素形成离子后,最外层都达到8电子稳定结构
- D: 同一主族元素的原子最外层电子数相同,化学性质完全相同
解析:
元素周期表中处于金属与非金属分界处的元素通常表现一定的金属性与非金属性,A项错误;第三周期主族元素的最高正价等于最外层电子数,即等于主族序数,B项正确;氢原子变成氢离子后,H+没有电子,C项错误;同一主族元素的原子最外层电子数相同,化学性质具有相似性和递变性,不完全相同,D项错误。
下列关于元素的化合价的说法正确的是( )
- A: 所有非金属元素都有最高正价+|最低负价|=8
- B: 氮元素的最高正价与最低负价绝对值之差为2
- C: 在所有的氧化物中,氧均为-2价
- D: 第ⅦA族的所有元素的最高正价均为+7价
解析:
氢元素最高正价+|最低负价|=2,A项错误;氮元素的最高正价为+5价,最低负价为-3价,B项正确;过氧化物(如H2O2、Na2O2)中,氧为-1价,C项错误;氟元素没有正价,D项错误。
(2023·长沙高一检测)元素的原子结构决定其性质和在周期表中的位置。下列说法正确的是( )
- A: 元素原子的最外层电子数等于元素的最高化合价
- B: 多电子原子中,在离核较近的区域内运动的电子能量较高
- C: P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强
- D: 非金属元素全部在元素周期表金属和非金属的分界线的右上方
解析:
O无最高正价,F没有正价,A错误;多电子原子中,能量低的电子在离核较近的区域内运动,B错误;P、S、Cl的非金属性依次增强,得电子能力与最高价含氧酸(H3PO4、H2SO4、HClO4)的酸性均依次增强,C正确;氢元素在元素周期表金属和非金属分界线的左上方,D错误。
下列说法错误的是( )
- A: 作半导体材料的元素大多数位于周期表中金属元素和非金属元素的交界处
- B: 农药中常含有的元素通常在元素周期表的右上方区域内
- C: 构成催化剂的元素通常在元素周期表的左下方区域内
- D: 在周期表过渡元素中寻找作耐高温和耐腐蚀合金的元素
解析:
构成催化剂的元素大多为过渡元素,在元素周期表的中间区域。
铬可用于制造不锈钢、汽车零件、工具、磁带和录像带等。铬的金属性位于锌和铁之间,根据元素周期律的知识,下列有关铬的性质说法不正确的是( )
- A: 铬与冷水能发生剧烈反应
- B: Cr(OH)3的碱性比NaOH的弱
- C: Cr2O3能与HCl反应
- D: 铬能与稀盐酸发生反应
解析:
由元素周期律知,金属性:Na>Al>Zn>Cr>Fe,Al与冷水不反应,故铬与冷水也不能发生剧烈反应。
铊是超导材料的组成元素之一,铊在周期表中位于第六周期,与铝是同主族元素,元素符号是Tl,以下对铊的性质推断不正确的是( )
- A: 铊是易导电的银白色金属
- B: 能生成+3价离子
- C: 氧化铊是两性氧化物
- D: Tl3+的氧化性比Al3+弱
解析:
同族元素性质有相似性,如铝是易导电的银白色金属,可形成+3价离子,则铊元素也具有上述性质,A、B正确;同主族元素随核电荷数的递增金属性逐渐增强,氧化铝是两性氧化物,则氧化铊是碱性氧化物而不具有两性,C错误。
镁、锂在元素周期表中具有特殊“对角线”关系,它们的性质相似。例如,它们的单质在过量氧气中燃烧时均只生成正常的氧化物等,下列关于锂的叙述不正确的是( )
- A: Li2SO4能溶于水
- B: LiOH是易溶于水、受热不分解的强碱
- C: Li与稀硫酸反应有H2生成
- D: Li2CO3受热分解,生成Li2O和CO2
解析:
由Mg、Mg(OH)2、MgCO3、MgSO4的性质推测相应的Li及其化合物的性质。MgSO4易溶于水,Mg(OH)2是难溶、易分解的中强碱,Mg与稀硫酸反应有H2生成,MgCO3受热易分解生成MgO和CO2,故B项不正确。
(2023·厦门市湖滨中学高一质检)某同学学习元素周期律后,作出以下推测,其中不正确的是( )
- A: Cl的核电荷数比Al大,推测Cl的原子半径比Al的原子半径大
- B: Sb是第五周期第ⅤA族的元素,推测NH3比SbH3稳定
- C: Cs的原子半径大于Na的原子半径,推测Cs与水反应比Na与水反应更剧烈
- D: Ra是第七周期第ⅡA族的元素,推测Ra(OH)2碱性比Ba(OH)2强
解析:
同周期主族元素从左到右原子半径递减,则Cl的原子半径比Al的原子半径小,A错误;同主族从上到下元素非金属性逐渐减弱,简单氢化物的稳定性逐渐减弱,Sb是第五周期第ⅤA族的元素,NH3比SbH3稳定,B正确;金属性越强,单质与水或氢离子反应越容易,同主族从上到下元素金属性逐渐增强,则Cs与水反应比Na与水反应更剧烈,因为Cs原子半径大于Na的原子半径,Cs比Na更容易失去电子、还原性更强,C正确;同主族从上到下元素金属性逐渐增强,最高价氧化物对应水化物的碱性逐渐增强,Ba是第六周期第ⅡA族的元素,Ra是第七周期第ⅡA族的元素,Ra(OH)2碱性比Ba(OH)2强,D正确。
(2023·重庆高一期末)元素周期表和元素周期律可以指导人们进行规律性地推测和判断。下列说法不正确的是( )
- A: 若X+和Y2-的核外电子层结构相同,则原子序数:X>Y
- B: 由水溶液的酸性:HCl>H2S,可推断出元素的非金属性:Cl>S
- C: 硅、锗都位于金属与非金属的分界线处,都可以作半导体材料
- D: Cs和Ba分别位于第六周期第ⅠA族和第ⅡA族,碱性:CsOH>Ba(OH)2
解析:
X+和Y2-的核外电子层结构相同,则离子核外电子数相同,设核外电子数为n,则X的原子序数为n+1,Y的原子序数为n-2,原子序数:X>Y,A正确;硅、锗都位于金属和非金属的分界线处,既有一定的金属性也有一定的非金属性,都可以作半导体材料,C正确。
借助碱金属和卤族元素的递变性分析下面的推断,其中正确的是( )
- A: 已知Ca是第四周期第ⅡA族的元素,故Ca(OH)2的碱性比Mg(OH)2的碱性弱
- B: 已知As是第四周期第ⅤA族的元素,故AsH3的稳定性比NH3的稳定性强
- C: 已知Cs的原子半径比Na的原子半径大,故Cs与水反应不如Na与水反应剧烈
- D: 已知Cl的核电荷数比F的核电荷数大,故Cl的原子半径比F的原子半径大
解析:
由碱金属元素和卤族元素的递变性可知,同主族元素从上到下金属性递增,非金属性递减,最高价氧化物对应的水化物碱性增强,非金属简单氢化物稳定性减弱,A、B、C错误;同主族元素随核电荷数增大,原子半径递增,D正确。
下表显示了元素周期表中的一部分,其中①~⑦为短周期元素,已知③与氢元素能组成生活中最常见的化合物,下列有关叙述错误的是( )
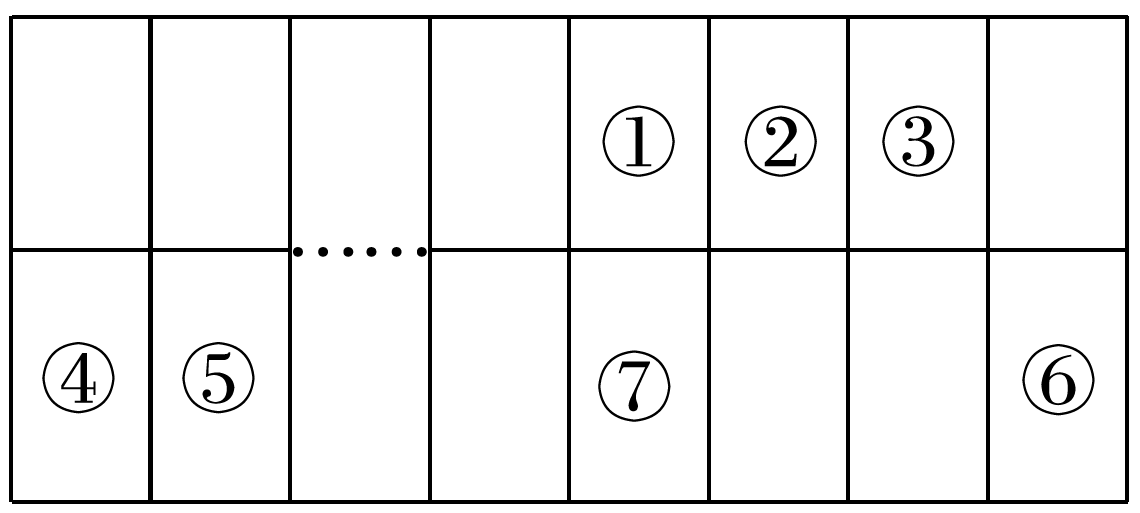
- A: 最高价氧化物对应水化物的酸性:①<②
- B: ③与氢元素可形成10电子化合物且呈中性
- C: 离子半径:⑤>④
- D: ⑦位于金属与非金属分界线处,可作半导体材料
解析:
③与氢元素能组成生活中最常见的化合物,应为H2O,故③为O,根据元素在周期表中的位置:②为N,①为C,④为Na,⑤为Mg,⑦为Si,⑥为Cl。①为C,②为N,同周期元素从左往右非金属性逐渐增强,故非金属性:N>C,最高价氧化物对应水化物的酸性:H2CO3<HNO3,A正确;③与氢元素形成的10电子化合物为H2O,呈中性,B正确;④为Na,⑤为Mg,核外电子排布相同,核电荷数越大离子半径越小,故离子半径:Na+>Mg2+,C错误;⑦为Si,位于金属与非金属分界线处,可作半导体材料,D正确。
1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。下列说法错误的是( )
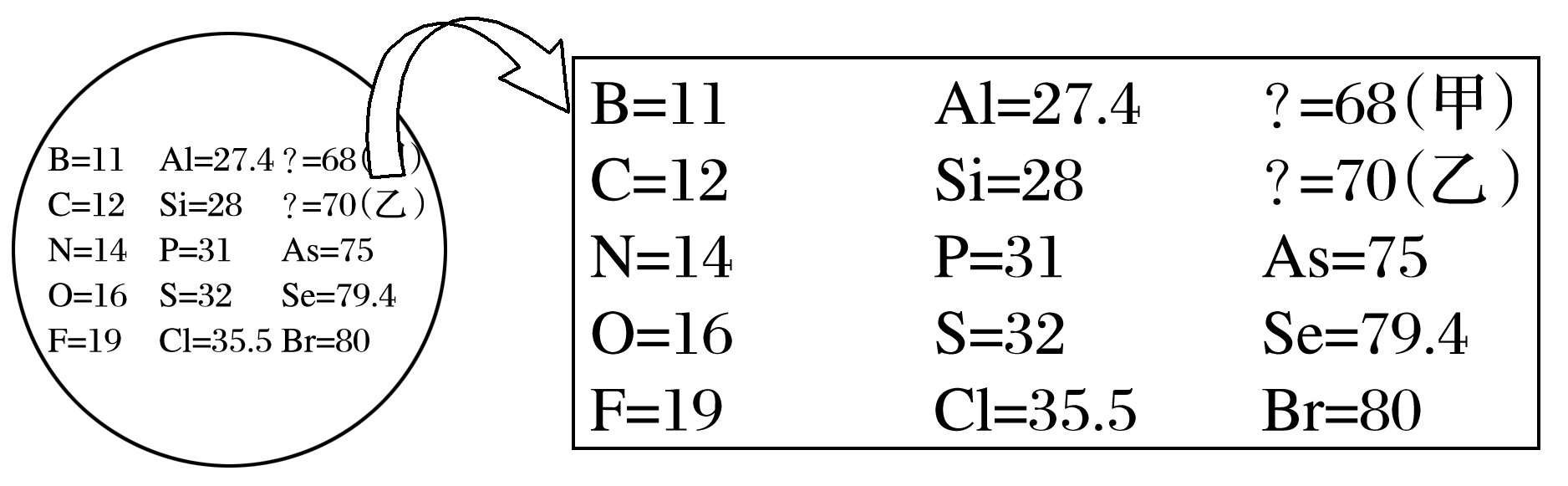
- A: 甲位于现行元素周期表第四周期第ⅢA族
- B: 原子半径:甲>乙>Si
- C: 乙的气态氢化物的稳定性强于CH4
- D: 推测乙的单质可以用作半导体材料
解析:
分析图中元素的排列方式,同一列元素位于同周期,同一横行元素位于同一主族,则甲位于现行元素周期表第四周期第ⅢA族,A正确;根据原子半径的变化规律,原子半径:甲>乙>Si,B正确;元素的非金属性:C>乙,则乙的气态氢化物的稳定性比CH4弱,C错误;乙处于周期表中金属元素和非金属元素的分界线附近,据此推测乙的单质可以用作半导体材料,D正确。
根据元素周期表回答下列问题:
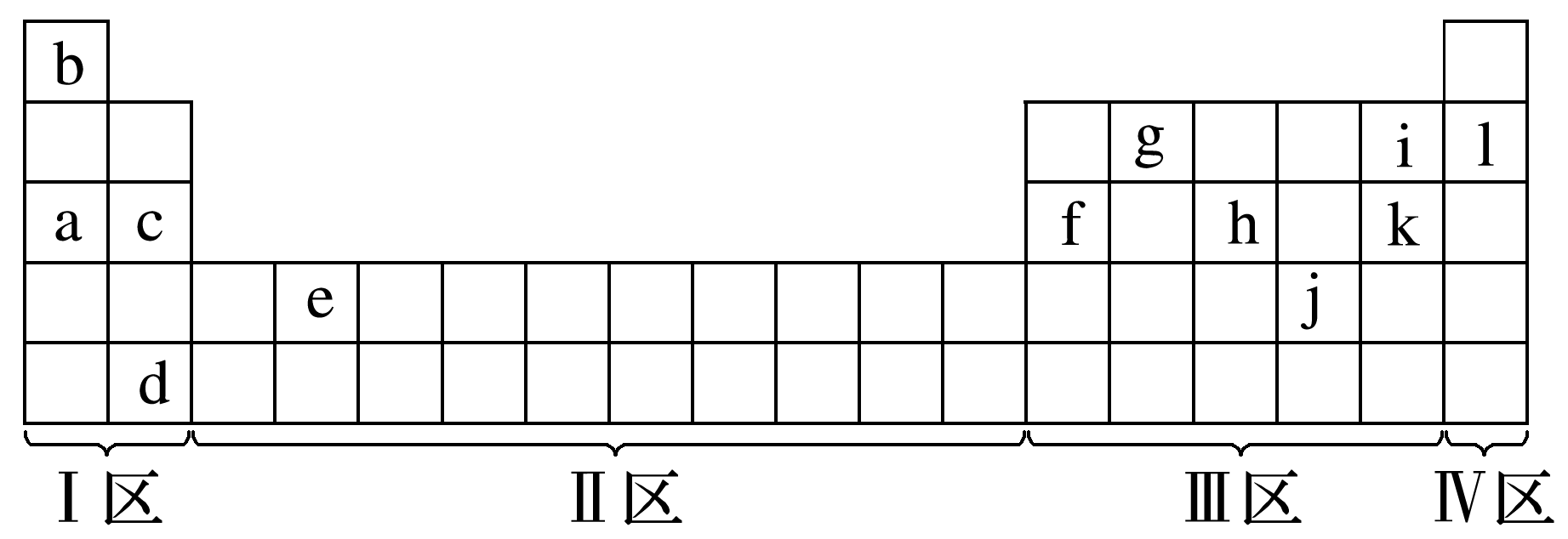
(1)在上面元素周期表中,全部是金属元素的区域为 (填字母)。
A.Ⅰ区 B.Ⅱ区
C.Ⅲ区 D.Ⅳ区
(2)a~l中,化学性质最不活泼的是 (填元素符号,下同)。只有负化合价而无正化合价的是 。
(3)a~l中,最高价氧化物对应水化物中呈两性的是 (填化学式,下同),写出它分别与a、k的最高价氧化物对应的水化物反应的离子方程式: 、 。
(4)a、c的最高价氧化物对应水化物的碱性: > 。
(5)核外电子层结构与l相同的几种微粒:X3-、Y-、Z+和W3+。
①X和Y的元素符号分别为 、 ,离子半径:X3- (填“>”“<”或“=”)Y-。
②Z和W的元素符号分别为 、 ,离子半径:Z+ (填“>”“<”或“=”)W3+。
答案: (1)B (2)Ne F (3)Al(OH)3 Al(OH)3+OH- [Al(OH)4]- Al(OH)3+3H+
[Al(OH)4]- Al(OH)3+3H+ Al3++3H2O (4)NaOH Mg(OH)2 (5)①N F > ②Na Al >
Al3++3H2O (4)NaOH Mg(OH)2 (5)①N F > ②Na Al >
解析:
(5)阴离子的核外电子数=质子数+电荷数,则X的质子数为7,Y的质子数为9,X、Y分别为N和F;阳离子的核外电子数=质子数-电荷数,则Z的质子数为11,W的质子数为13,则Z、W分别为Na和Al。
下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:
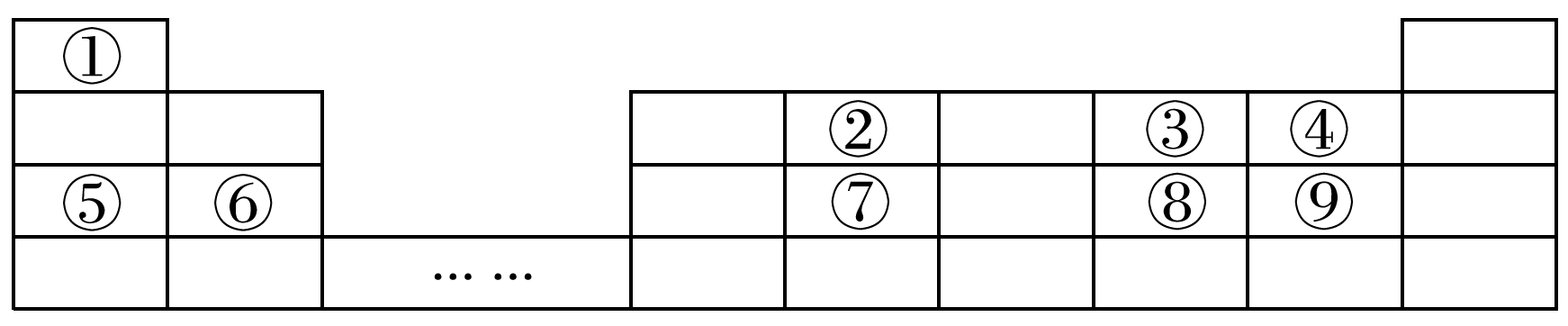
(1)表中用于半导体材料的元素在周期表中的位置是 。
(2)写出短周期非金属性最强的元素的离子结构示意图: 。
(3)③④⑤三种元素离子半径从大到小的顺序是 (填离子符号)。
(4)②③④的气态氢化物,稳定性最强的是 (填化学式)。
(5)在一定条件下,利用置换反应可实现物质之间的转化(仅限于①~⑨中涉及的元素)。
①同族元素之间,则反应可能为 。
②不同族元素之间,则反应可能为 。
(以上反应各写一个化学方程式即可)
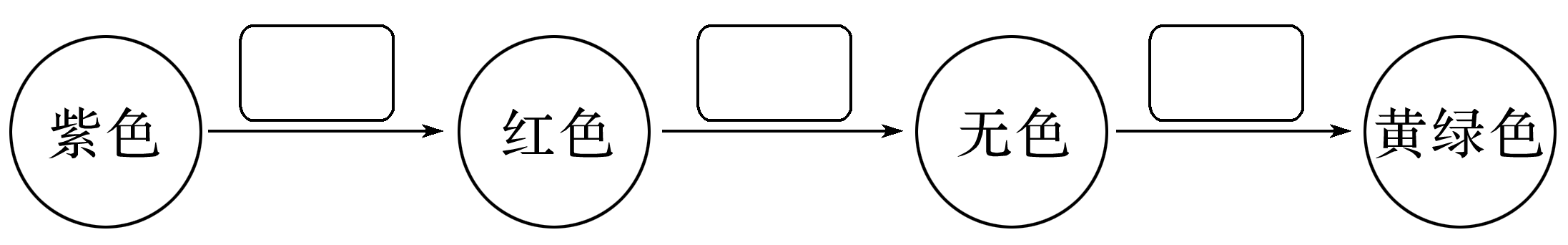
(6)将⑨的单质通入石蕊溶液中发生的颜色变化如图,请在方框内填写出导致该阶段颜色变化的主要粒子符号。
答案: (1)第三周期第ⅣA族
(2)
(3)O2->F->Na+
(4)HF
(5)①2Na+2H2O 2NaOH+H2↑ ②Mg+2HCl
2NaOH+H2↑ ②Mg+2HCl MgCl2+H2↑ (或2Mg+CO2
MgCl2+H2↑ (或2Mg+CO2 2MgO+C)
2MgO+C)
(6)H+ HClO Cl2
解析:
根据各元素在周期表中的相对位置可知,①为H元素、②为C元素、③为O元素、④为F元素、⑤为Na元素、⑥为Mg元素、⑦为Si元素、⑧为S元素、⑨为Cl元素。(2)短周期非金属性最强的元素为F,F-的结构示意图为 。(3)具有相同电子层结构的离子半径随着原子序数的增大而减少,所以③④⑤三种元素的离子半径由大到小的顺序为O2->F->Na+。(4)元素非金属性越强,其气态氢化物稳定性越强。(6)⑨为Cl元素,其单质为氯气,将氯气通入石蕊溶液中反应生成HCl、HClO,溶液呈酸性,H+使溶液变红色,HClO具有漂白性,又使溶液红色褪去,氯气最终溶于溶液中,使溶液呈黄绿色。
。(3)具有相同电子层结构的离子半径随着原子序数的增大而减少,所以③④⑤三种元素的离子半径由大到小的顺序为O2->F->Na+。(4)元素非金属性越强,其气态氢化物稳定性越强。(6)⑨为Cl元素,其单质为氯气,将氯气通入石蕊溶液中反应生成HCl、HClO,溶液呈酸性,H+使溶液变红色,HClO具有漂白性,又使溶液红色褪去,氯气最终溶于溶液中,使溶液呈黄绿色。




