第二章 智能作业3 碳酸钠和碳酸氢钠 焰色试验
(2024·四川遂宁高一期末)烘焙糕点常用NaHCO3做膨松剂。下列关于NaHCO3的性质说法正确的是( )
- A: 焰色试验呈紫色
- B: 水溶液显酸性
- C: 淡黄色固体
- D: 受热易分解
解析:
钠元素的焰色试验应该呈黄色,A错误;NaHCO3水溶液显碱性,B错误;NaHCO3为细小的白色晶体,C错误。
(2023·江苏无锡一中高一期中)Na2CO3和NaHCO3都是重要的化工原料。下列说法正确的是( )
- A: 碳酸钠俗名小苏打,碳酸氢钠俗名纯碱
- B: 同浓度的两溶液碱性:Na2CO3<NaHCO3
- C: 热稳定性:Na2CO3<NaHCO3
- D: 碳酸氢钠溶液中加入适量氢氧化钠,便可转化为碳酸钠溶液
解析:
Na2CO3俗名为苏打或者纯碱,NaHCO3俗名为小苏打,A错误;同浓度的两溶液碱性:Na2CO3>NaHCO3,B错误;NaHCO3受热易分解为Na2CO3、CO2和H2O,而碳酸钠受热不分解,即热稳定性:Na2CO3>NaHCO3,C错误。
某兴趣小组根据课本实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验如图。请观察如图实验装置并分析实验原理,判断下列说法错误的是( )
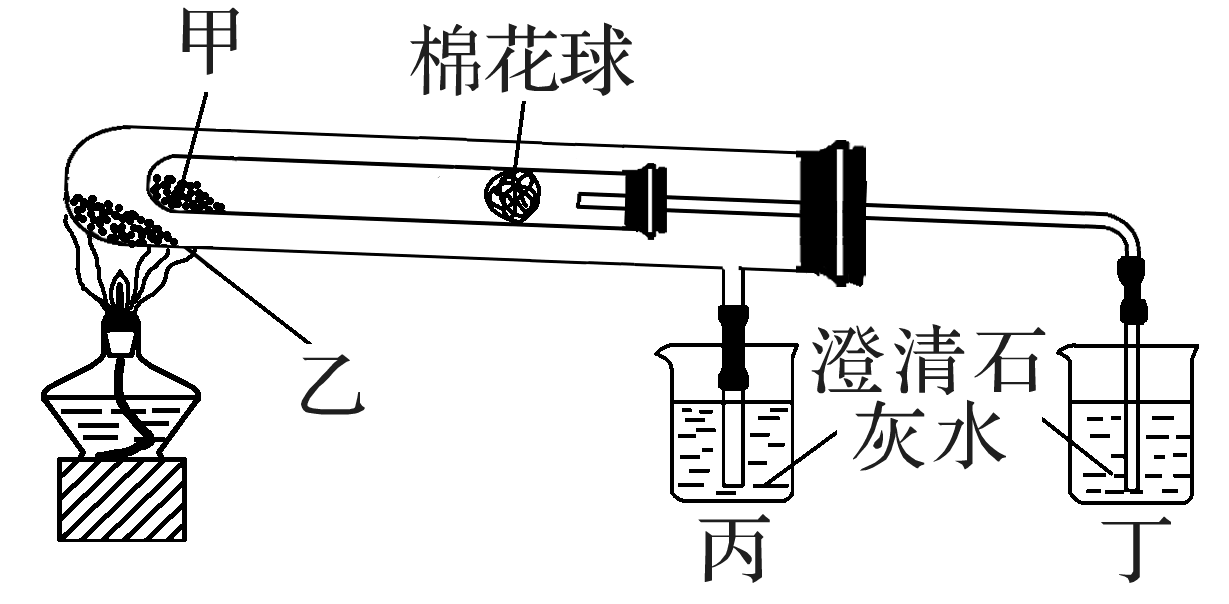
- A: 甲为NaHCO3,乙为Na2CO3
- B: 甲为Na2CO3,乙为NaHCO3
- C: 要证明物质受热能产生水,可在两支试管内塞入沾有无水硫酸铜粉末的棉花球
- D: 整个实验过程中可以看到丙烧杯的澄清石灰水不变浑浊
解析:
用酒精灯加热时,外管温度高,内管温度低,NaHCO3受热易分解,Na2CO3受热不易分解,故将Na2CO3放在外管中,温度高却未分解,NaHCO3放在内管中,温度低却分解,证明Na2CO3的热稳定性强于NaHCO3,NaHCO3受热分解产生CO2,可使澄清石灰水变浑浊,故A、D项正确,B项错误;NaHCO3分解产生的水可以使无水硫酸铜变蓝色,故C项正确。
下列有关Na2CO3与NaHCO3叙述错误的是( )
- A: 相同状况下,等质量的NaHCO3和Na2CO3分别与足量盐酸反应,Na2CO3产生的CO2气体体积小于NaHCO3
- B: 反应放出等量的CO2所消耗的酸:NaHCO3>Na2CO3
- C: 选用NaHCO3而不选择Na2CO3治疗胃酸过多,其原因为Na2CO3的碱性太强
- D: Na2CO3溶液中混有少量NaHCO3杂质,可加入适量NaOH除去
解析:
根据反应:NaHCO3+HCl NaCl+CO2↑+H2O,Na2CO3+2HCl
NaCl+CO2↑+H2O,Na2CO3+2HCl 2NaCl+CO2↑+H2O,相同质量的NaHCO3和Na2CO3分别与足量盐酸反应,Na2CO3产生的CO2气体少,A正确;碳酸钠碱性较强,具有腐蚀性,不能用于治疗胃酸过多,可以用碳酸氢钠,C正确。
2NaCl+CO2↑+H2O,相同质量的NaHCO3和Na2CO3分别与足量盐酸反应,Na2CO3产生的CO2气体少,A正确;碳酸钠碱性较强,具有腐蚀性,不能用于治疗胃酸过多,可以用碳酸氢钠,C正确。
已知两支试管中分别装有等浓度的Na2CO3和NaHCO3溶液,下列操作或判断正确的是( )
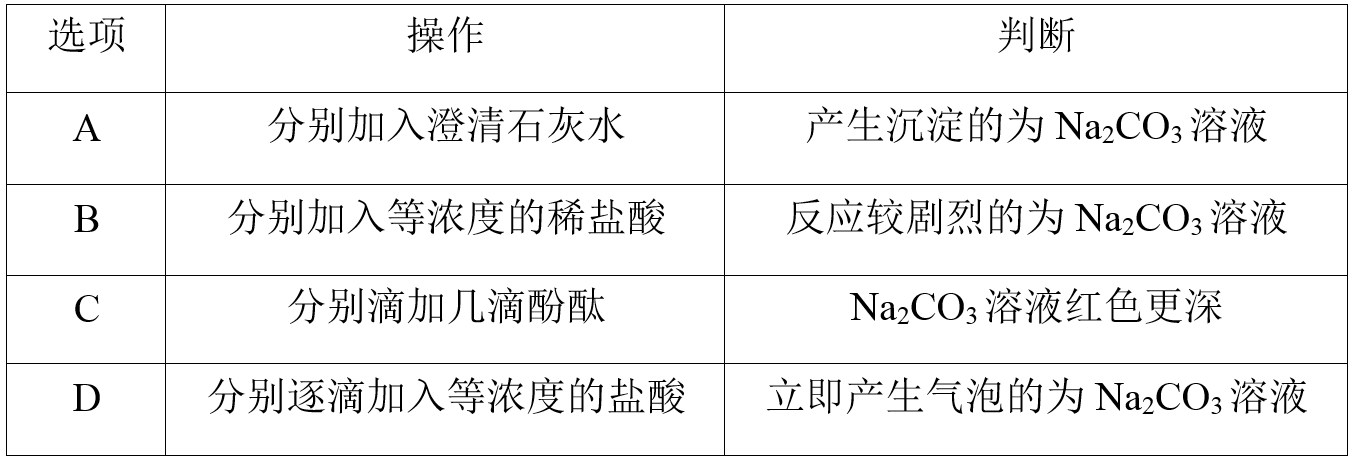
- A: 答案A
- B: 答案B
- C: 答案C
- D: 答案D
解析:
碳酸钠和碳酸氢钠均能与Ca(OH)2反应产生沉淀,A错误;向Na2CO3中逐滴加入盐酸时,开始无气体产生,当盐酸加入较多时,可产生气体,而向NaHCO3中加入同浓度盐酸,立即产生气体,产生气体较为剧烈的为碳酸氢钠,B、D错误;等浓度的碳酸钠和碳酸氢钠溶液,碳酸钠溶液的碱性更强,溶液红色更深,C正确。
某同学用洁净的铂丝蘸取某无色溶液在酒精灯外焰上灼烧,火焰呈黄色,通过该实验现象,下列四位同学对该溶液中存在的金属离子判断正确的是( )
解析:
钠元素的焰色为黄色,钾元素的焰色为紫色,观察钾元素的焰色时必须透过蓝色钴玻璃。根据题中现象只能确定有Na+,而不能确定K+的有无。
(2023·济南调研)下列有关焰色试验操作的描述正确的是( )
- A: 在观察焰色时均要透过蓝色钴玻璃,以便排除钠元素的黄光干扰
- B: 取一根洁净的细铂丝,放在酒精灯上灼烧至与火焰颜色相同,再蘸取少量NaCl溶液,进行焰色试验
- C: 铂丝在做完氯化钠溶液的焰色试验后,用稀硫酸洗净,再蘸取少量的K2SO4溶液,重复以上实验
- D: 灼烧时,所有金属或金属阳离子均有焰色
解析:
在观察钾的焰色要透过蓝色钴玻璃片,其他物质不需要,故A错误;做焰色试验结束后铂丝要用稀盐酸洗涤,灼烧至与酒精灯火焰颜色相同后再使用,故C错误。
下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
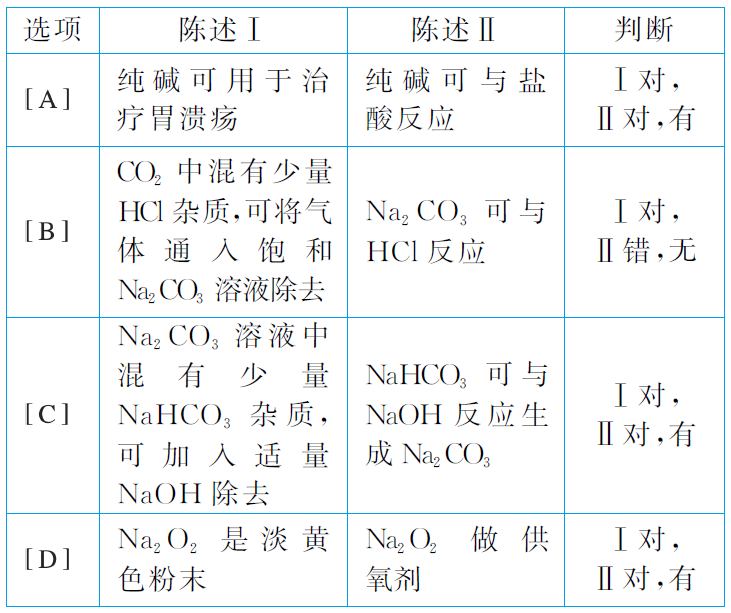
- A: 答案A
- B: 答案B
- C: 答案C
- D: 答案D
解析:
碳酸钠能够与盐酸反应,但是碳酸钠碱性较强,具有腐蚀性,不能用于治疗胃溃疡,陈述Ⅰ错误,A错误;HCl和CO2通入饱和Na2CO3溶液中均会发生反应,因此不能用饱和Na2CO3溶液除去CO2中少量的HCl杂质,陈述Ⅰ错误,B错误;NaHCO3可与NaOH反应生成Na2CO3和H2O,因此可用适量的NaOH溶液除去Na2CO3溶液中混有的少量NaHCO3杂质,陈述Ⅰ和陈述Ⅱ都对,且具有因果关系,C正确;Na2O2能和人体呼出的CO2和H2O反应生成O2,因而可做供氧剂,与Na2O2是淡黄色粉末无因果关系,即陈述Ⅰ和陈述Ⅱ无因果关系,D错误。
下列物质鉴别的方法正确的是 ( )
①用BaCl2溶液鉴别Na2CO3溶液和NaHCO3溶液 ②用观察法鉴别Na2O和Na2O2 ③用MgCl2溶液鉴别Na2CO3溶液和NaOH溶液 ④用稀盐酸鉴别相同浓度相同体积的Na2CO3溶液和NaHCO3溶液
- A: ①②④
- B: ①②
- C: ②③
- D: ①②③④
解析:
①Na2CO3溶液与BaCl2溶液反应生成BaCO3沉淀,而NaHCO3溶液与BaCl2溶液不反应,可以鉴别;②Na2O为白色固体,Na2O2为淡黄色固体,可以用观察法鉴别;③Na2CO3溶液和NaOH溶液都能与MgCl2溶液反应产生白色沉淀,故不能用MgCl2溶液鉴别;④可以根据稀盐酸与相同浓度相同体积的Na2CO3溶液和NaHCO3溶液反应产生CO2的快慢鉴别两溶液。
某固体混合物中可能含有:K+、Na+、Cl-、C、S等离子,将该固体溶解所得到的溶液进行了如下实验:
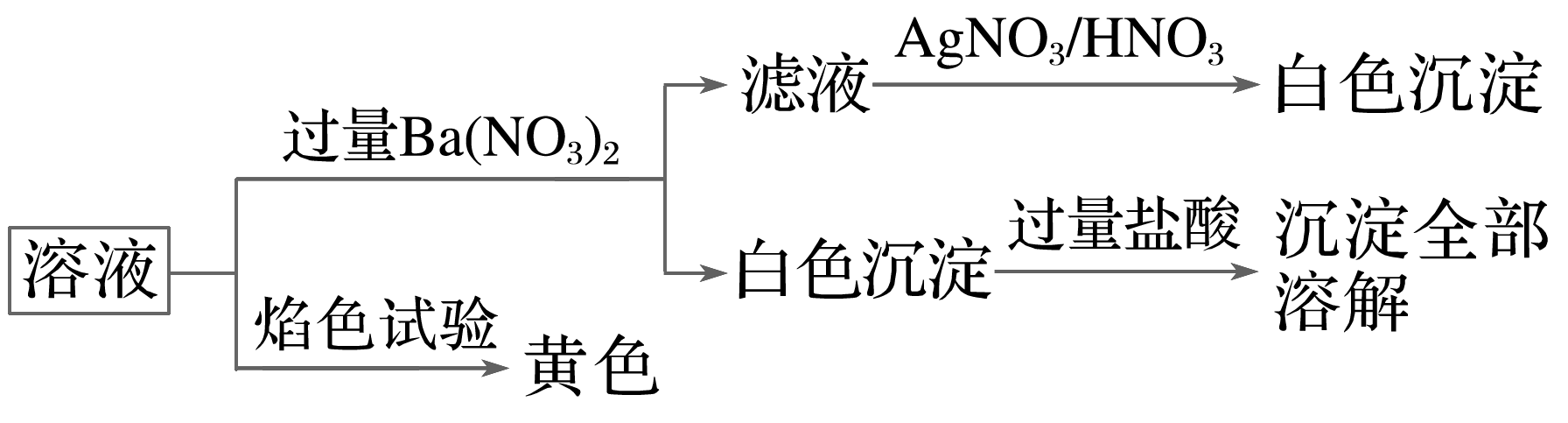
下列说法正确的是( )
- A: 该混合物一定是K2CO3和NaCl
- B: 该混合物可能是Na2CO3和KCl
- C: 该混合物可能是Na2SO4和Na2CO3
- D: 该混合物一定是Na2CO3和NaCl
解析:
焰色试验显黄色,一定含Na+,可能含有K+,与过量硝酸钡反应生成的白色沉淀全部溶于过量盐酸,则沉淀为碳酸钡,一定含C,而不含S,滤液与硝酸银反应生成不溶于硝酸的白色沉淀为AgCl,可知一定含Cl-。
过碳酸钠(2Na2CO3·3H2O2)又称固体过氧化氢,能杀灭病毒,是一种良好的消毒剂,也可作为漂白剂、去污剂。下列说法不正确的是( )
- A: 过碳酸钠具有强氧化性
- B: 可预测过碳酸钠不稳定,受热易分解
- C: 含有二氧化锰或高温条件不影响过碳酸钠的保存
- D: 向过碳酸钠溶于水后的溶液中滴入澄清石灰水,会出现白色沉淀
解析:
过碳酸钠(2Na2CO3·3H2O2)具有碳酸钠和过氧化氢的性质,所以具有强氧化性,故A正确;2Na2CO3·3H2O2不稳定,受热易分解生成氧气,故B正确;二氧化锰可以作为过氧化氢分解的催化剂,高温促进过氧化氢分解,所以二氧化锰或高温会影响过碳酸钠的保存,故C错误;过碳酸钠溶液与澄清石灰水反应生成碳酸钙沉淀,故D正确。
妈妈教小鲁蒸馒头:先用酵头发面,面团发酵至两倍大后,再加纯碱调节酸性,然后将面团揉切后上锅蒸即可。小鲁查阅资料得知,酵头可使面团在微生物作用下产生CO2气体,从而使面团疏松,但同时也会产生乳酸、醋酸等有机酸。
(1)下列关于纯碱的认识正确的是 (填字母)。
A.受热易分解 B.水溶液显碱性
C.属于碱 D.可与酸反应
(2)小鲁实际操作时,发现面团发得不好,面团内的气孔少,略有酸味。妈妈指导小鲁将Na2CO3改用NaHCO3,继续揉面,上锅蒸后果然蒸出了松软的馒头。该过程中NaHCO3的作用为 。
(3)为探究碳酸钠和碳酸氢钠的性质,小鲁利用如图所示装置进行NaHCO3的受热分解实验。
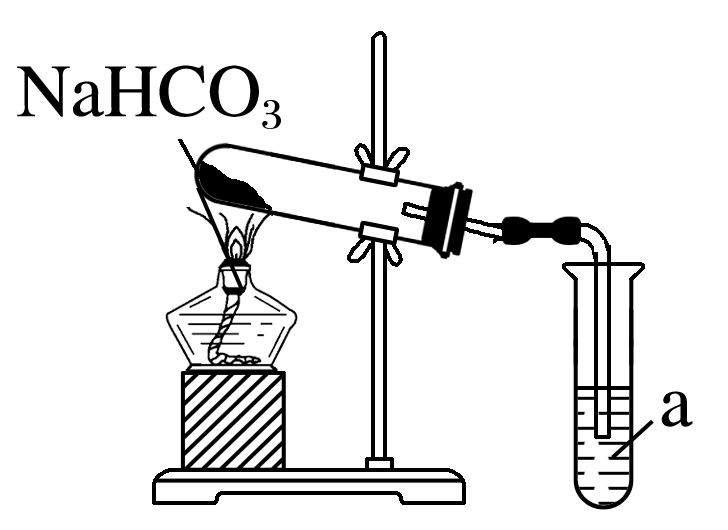
①安装好仪器后首先应该进行的操作是 。
②试管a中盛放的试剂是 。
③NaHCO3受热分解的化学方程式是 。
答案: (1)BD (2)受热分解产生CO2气体,从而使面团疏松,和乳酸、醋酸等有机酸反应,减少酸味 (3)检查装置气密性 澄清石灰水 2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
解析:
(3)反应过程中会产生气体,安装好仪器后首先应该进行的操作是检查装置气密性;试管a的作用是检验二氧化碳,故试管a中盛放的试剂是澄清石灰水;碳酸氢钠分解会产生碳酸钠、水和二氧化碳,反应的化学方程式为2NaHCO3 Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
(2024·河北沧州高一月考)膨松剂是在食品加工过程中加入的,能使面坯发起形成多孔组织的,使食品具有松软和酥脆特点的一类物质,其有效物质为NaHCO3。某兴趣小组为研究某膨松剂的性质,设计了如下实验:
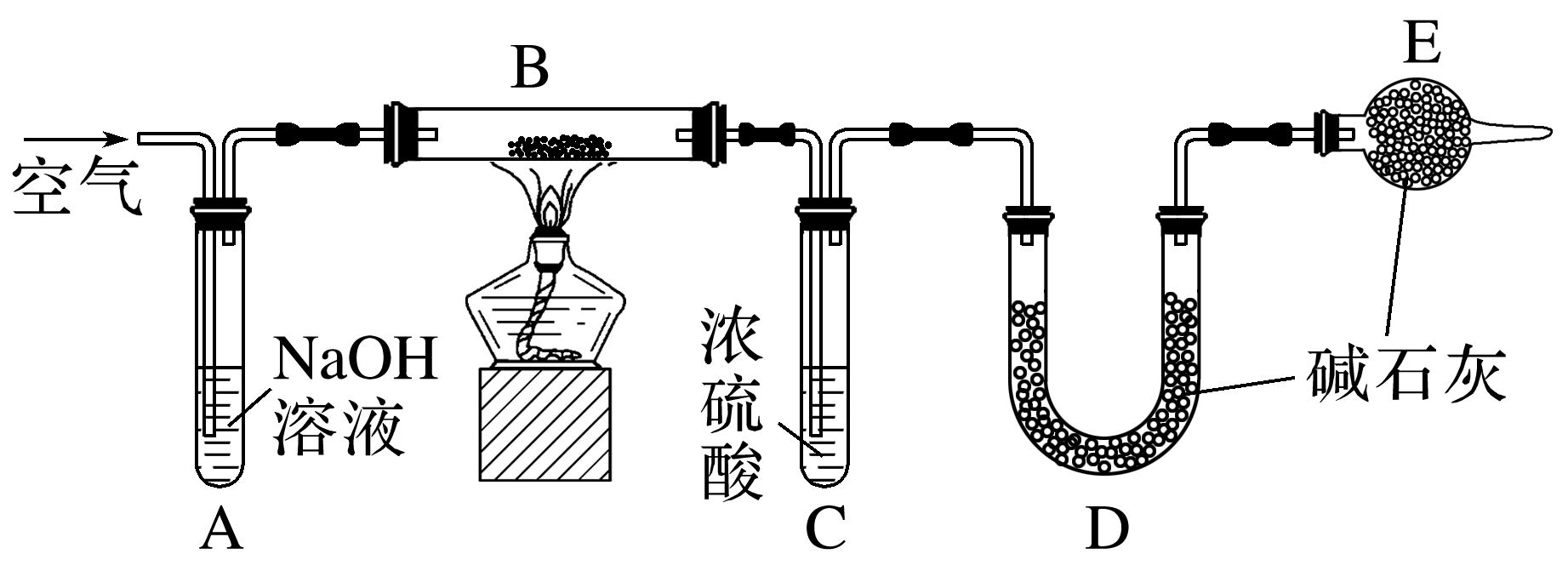
已知:①碱石灰是固体氧化钙和氢氧化钠的混合物。装置气密性良好,且各装置中试剂皆过量。
②在加热情况下的产气量(CO2)是检验膨松剂品质的一项重要指标。
(1)装置A中NaOH溶液的作用为 ,装置E中碱石灰的作用为 。
(2)将一定质量的膨松剂置于B中,B中发生的反应为 。
(3)实验时先连接好装置A、B和C,通入一段时间空气,再连接上装置D、E;点燃酒精灯开始实验;充分反应后停止加热,应继续通入一段时间空气,这样做的目的是 。
(4)实验结束后称量装置 的质量差即为膨松剂的产气量。
(5)如果取5 g膨松剂样品,测得产气量为0.44 g,则该膨松剂的有效成分的百分含量为 。
答案: (1)除去空气中的二氧化碳 防止空气中的二氧化碳和水蒸气进入到装置D被吸收影响实验
(2)2NaHCO3 Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
(3)将生成的二氧化碳全部赶入装置D中,让其全部被碱石灰吸收
(4)D
(5)33.6%
解析:
(3)实验时先连接好装置A、B和C,通入一段时间空气,排尽装置中的空气(CO2),再连接上装置D、E;点燃酒精灯开始实验;充分反应后停止加热,应继续通入一段时间空气,这样做的目的是排干净生成的CO2,让其全部被碱石灰吸收,准确测量膨松剂的含量。(4)装置D的作用是吸收膨松剂分解产生的CO2。(5)5 g样品生成CO2质量为0.44 g,根据2NaHCO3 Na2CO3+H2O+CO2↑知5 g膨松剂样品中含1.68 g碳酸氢钠,则该膨松剂的有效成分的百分含量为×100%=33.6%。
Na2CO3+H2O+CO2↑知5 g膨松剂样品中含1.68 g碳酸氢钠,则该膨松剂的有效成分的百分含量为×100%=33.6%。
 CO2↑+H2O
CO2↑+H2O CO2↑+H2O
CO2↑+H2O BaCO3↓+H2O
BaCO3↓+H2O CaCO3↓+C+2H2O
CaCO3↓+C+2H2O![]() CO2↑+H2O,故A错误;碳酸钠和硫酸反应生成硫酸钠、二氧化碳和水,离子方程式为+2H+
CO2↑+H2O,故A错误;碳酸钠和硫酸反应生成硫酸钠、二氧化碳和水,离子方程式为+2H+![]() CO2↑+H2O,故B正确;碳酸氢钠溶液中滴入少量氢氧化钡溶液,正确的离子方程式为Ba2++2HC+2OH-
CO2↑+H2O,故B正确;碳酸氢钠溶液中滴入少量氢氧化钡溶液,正确的离子方程式为Ba2++2HC+2OH-![]() BaCO3↓+2H2O+C,故C错误;碳酸氢钠溶液中滴入足量氢氧化钙溶液,反应生成碳酸钙、氢氧化钠和水,反应的离子方程式为Ca2++HC+OH-
BaCO3↓+2H2O+C,故C错误;碳酸氢钠溶液中滴入足量氢氧化钙溶液,反应生成碳酸钙、氢氧化钠和水,反应的离子方程式为Ca2++HC+OH-![]() CaCO3↓+H2O,故D错误。
CaCO3↓+H2O,故D错误。








