(2024·哈尔滨高一期末)化学学习时引入数学集合思想可以帮助我们更好地分析物质类别或反应之间的关系。下列符合图示表达方式的是( )
![]()
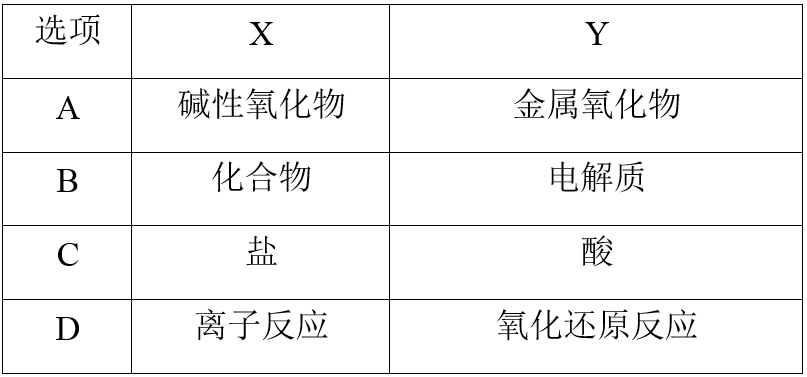
- A: 答案A
- B: 答案B
- C: 答案C
- D: 答案D
解析:
碱性氧化物都是金属氧化物,二者为包含关系,A错误;电解质都是化合物,二者为包含关系,B错误;盐和酸属于并列关系,C错误;一部分离子反应是氧化还原反应,一部分氧化还原反应是离子反应,两者属于交叉关系,D正确。
(2024·深圳高一联考)化学与生活、社会发展息息相关,下列说法不正确的是( )
解析:
萃取是物理变化,故选B。
(2023·山东泰安高一上期中)泰山有三美:白菜、豆腐、水。泰山豆腐无苦味,无涩味,细嫩如玉似脂,其制作工艺:用小石磨推沫,用泰山水成浆,加石膏(CaSO4)制成。下列说法不正确的是( )
解析:
豆腐含有多种成分,为混合物,故选A。
(2023·广西南宁三中高一月考)北京时间2023年10月26日11时14分,搭载神舟十七号载人飞船的长征二号F遥十七运载火箭在酒泉卫星发射中心点火发射,发射取得圆满成功。长征二号F运载火箭系列选用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)组成双元动力推进剂。下列有关推进剂说法正确的是( )
(2024·贵州毕节高一段考)下列物质分类正确的是( )
解析:
CaO为碱性氧化物,A错误;氯化铁溶液是溶液,不属于胶体,B错误;酒精是非电解质,C错误。
(2024·哈尔滨高一期末)化学学习时引入数学集合思想可以帮助我们更好地分析物质类别或反应之间的关系。下列符合图示表达方式的是( )
![]()

解析:
碱性氧化物都是金属氧化物,二者为包含关系,A错误;电解质都是化合物,二者为包含关系,B错误;盐和酸属于并列关系,C错误;一部分离子反应是氧化还原反应,一部分氧化还原反应是离子反应,两者属于交叉关系,D正确。
(2023·杭州高一检测)磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性。制备时将FeSO4和Fe2(SO4)3溶液混合,再滴入稍过量的NaOH溶液,随后加入油酸钠溶液,即可生成黑色的、分散质粒子直径为36~55 nm的磁流体。下列说法正确的是( )
解析:
胶体是混合物,所以该磁流体为混合物,故A错误;由颜色可知,该分散质不是Fe(OH)3,故B错误;胶体能透过滤纸,故C错误;胶体能产生丁达尔效应,所以该磁流体能产生丁达尔效应,故D正确。
(2024·河南新乡一中高一联考)在指定环境中,下列微粒均可以大量存在的是( )
解析:
Fe3+和OH-反应生成Fe(OH)3沉淀,H+和OH-反应生成水,不能大量共存,A错误;和Ba2+反应生成BaSO4沉淀,不能大量共存,B错误;碳酸钠电离出的C可以和Ca2+反应生成CaCO3沉淀,不能大量共存,C错误。
(2023·呼和浩特高一统考)准确书写离子方程式有助于我们认识化学反应的实质。下列离子方程式的书写正确的是( )
解析:
铜和稀盐酸不反应,A错误;碳酸钙不能拆,正确的离子方程式为CaCO3+2H+===Ca2++H2O+CO2↑,C错误;硫酸铜溶液与氢氧化钡溶液混合生成硫酸钡沉淀、氢氧化铜沉淀,正确的离子方程式为Ba2++2OH-+Cu2+===BaSO4↓+Cu(OH)2↓,D错误。
如图是某同学学习《常见的碱》课题后,总结出氢氧化钙的化学性质。下列说法不正确的是( )
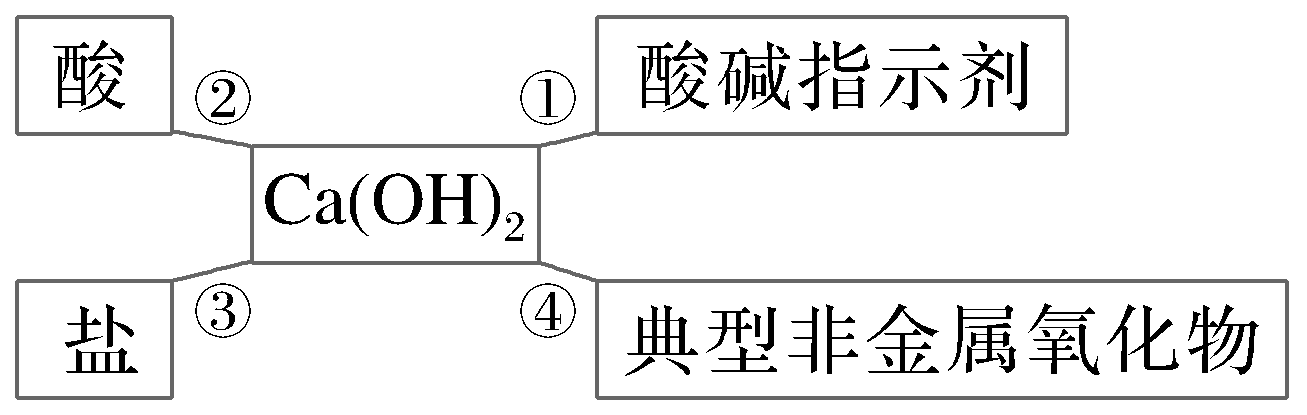
解析:
①中Ca(OH)2能使酚酞溶液变红,A正确;③中NaNO3与Ca(OH)2不反应,C错误;④中久置的澄清石灰水变质的原因是Ca(OH)2+CO2![]() CaCO3↓+H2O,D正确。
CaCO3↓+H2O,D正确。
(2024·长安一中高一段考)下列各组中反应 Ⅰ 和反应 Ⅱ 能用同一离子方程式表示的是( )
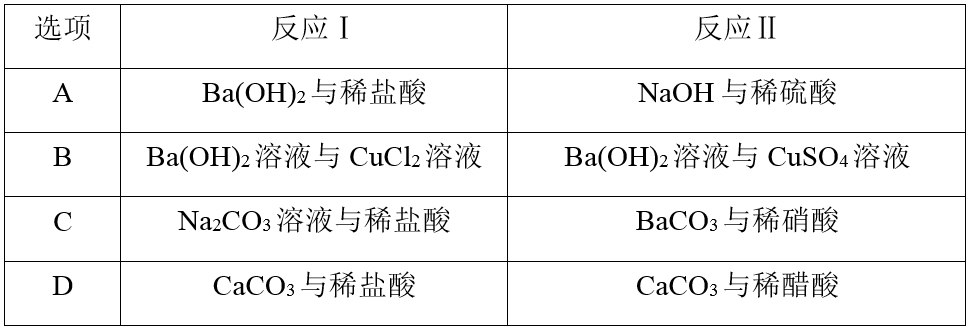
解析:
A项,Ba(OH)2与稀盐酸、NaOH与稀硫酸反应的离子方程式都为OH-+H+===H2O;B项,前者反应的离子方程式为Cu2++2OH-===Cu(OH)2↓,后者反应的离子方程式为Ba2++S+Cu2++2OH-===BaSO4↓+Cu(OH)2↓,离子方程式不相同;C项,前者反应的离子方程式为+2H+===CO2↑+H2O,后者反应的离子方程式为BaCO3+2H+===Ba2++CO2↑+H2O,离子方程式不相同;D项,前者反应的离子方程式为CaCO3+2H+===Ca2++CO2↑+H2O,后者反应的离子方程式为2CH3COOH+CaCO3===CO2↑+Ca2++2CH3COO-+H2O,离子方程式不相同。
(2023·云南宣威三中高一段考)利用辉铜矿冶炼铜时涉及反应Cu2S+O2![]() 2Cu+SO2,下列有关该反应的说法错误的是( )
2Cu+SO2,下列有关该反应的说法错误的是( )
解析:
由化学方程式可知,反应中Cu元素、O元素的化合价均降低,被还原,Cu2S、O2是反应的氧化剂,S元素化合价升高,被氧化,Cu2S是反应的还原剂,铜、SO2都是还原产物,故B错误,C正确;该反应中,1个氧气分子得到4个电子,硫化亚铜得到2个电子,则每消耗1个O2分子,反应中转移6个电子,故D正确。
把碎纸片b补充到a中,可得到一个完整的离子方程式(未配平),下列说法正确的是( )
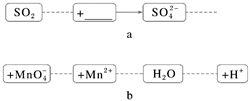
解析:
由纸条上信息可知,SO2为还原剂,则氧化剂应为Mn,反应的离子方程式为5SO2+2Mn+2H2O===5S+2Mn2++4H+,因此反应物微粒为SO2、Mn和H2O,A、D错误;氧化剂为Mn,还原剂为SO2,二者化学计量数之比为2∶5,C错误。
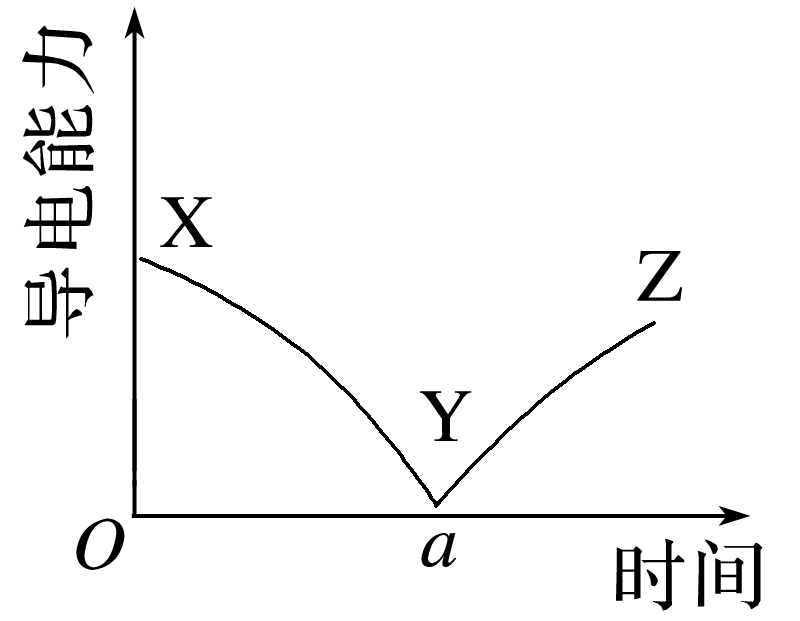
(2023·金华高一期末)某班同学分组进行向一定体积的Ba(OH)2溶液中逐滴滴加稀硫酸的实验,并通过数字传感器测得混合溶液的导电能力随时间变化的曲线如图所示。下列有关说法正确的是( )
解析:
NaOH与稀硫酸反应生成Na2SO4,Na2SO4溶于水完全电离,故不会出现导电能力接近零的点,A错误;该反应对应的离子方程式为2H++S+Ba2++2OH-===BaSO4↓+2H2O,B错误;BaSO4难溶于水,导致溶液中离子浓度减小,导电能力减弱,但BaSO4是电解质,C错误;YZ段溶液的导电能力不断增大,表明随着稀硫酸的不断加入,溶液中离子浓度不断增大,主要原因是过量H2SO4电离引起的,D正确。
用下列方法均可制得氯气:
①MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
③2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
若要制得相同质量的氯气,①②③反应中电子转移数目之比为( )
解析:
设三个反应都生成3个Cl2分子,则电子转移的数目分别为6、5、6,A项正确。
某工业废水中存在大量的Na+、Cl-、Cu2+、S,欲除去其中的Cu2+、S,设计工艺流程如图所示:
![]()
下列有关说法错误的是( )
解析:
工业废水中存在大量的Na+、Cl-、Cu2+、S,欲除去其中的 Cu2+、S,由实验流程可知,先加NaOH除去Cu2+,然后加试剂a为BaCl2,可除去S,再加试剂b为Na2CO3,试剂b可除去过量钡离子,操作X为过滤,分离出的溶液含氯化钠、碳酸钠,最后加试剂c为稀盐酸,可除去碳酸钠,故A、C正确,B错误;检验S是否除尽可取适量待测溶液,先加入盐酸,排除干扰离子,再加入BaCl2溶液,若不生成白色沉淀,则除尽,反之没有除尽,故D正确。
硫化氢(H2S)是一种有毒、有害的不良气体。处理某废气中的H2S,是将废气与空气混合通入FeCl2、CuCl2、FeCl3的混合液中,其转化的流程如图所示。下列说法正确的是( )
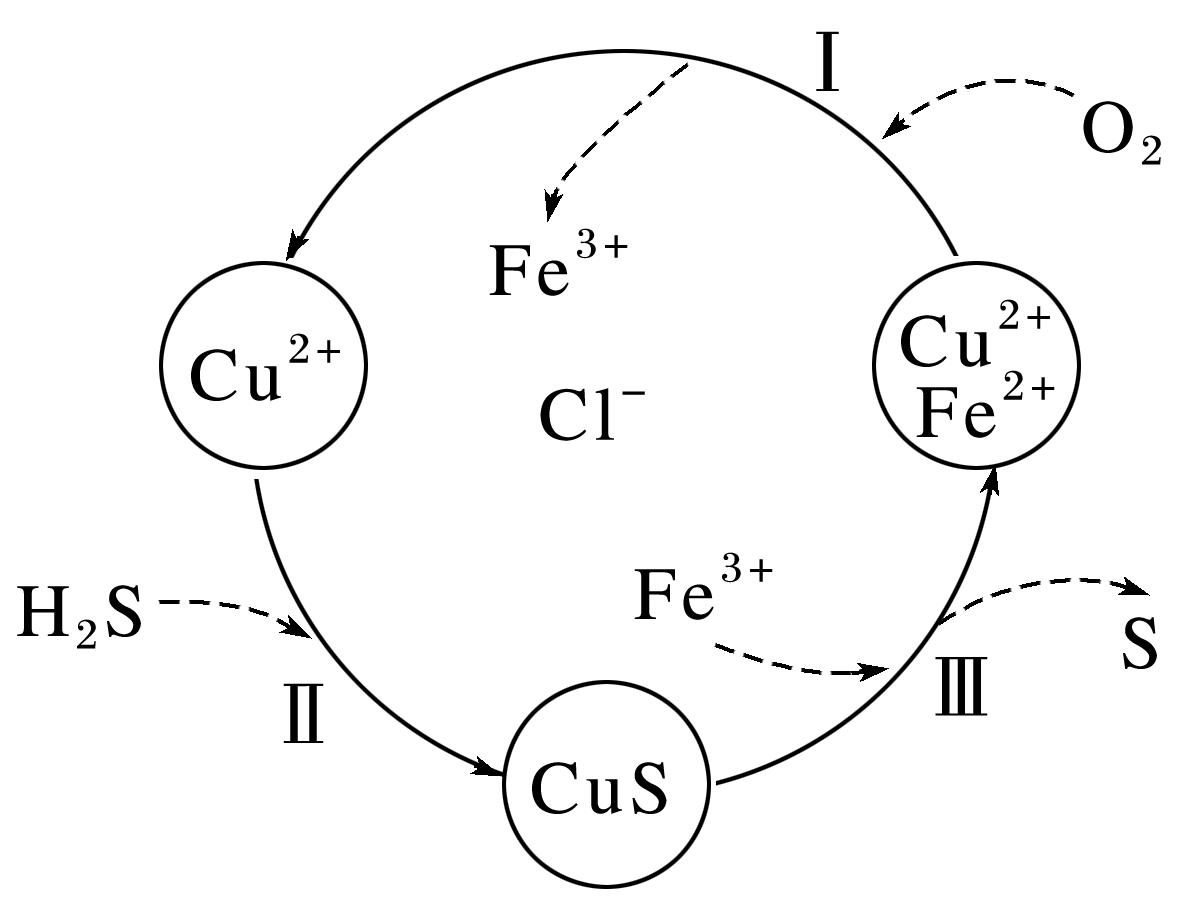
解析:
由图可知,过程 Ⅰ 中亚铁离子被氧气氧化为铁离子,过程 Ⅲ 中铁离子又被硫化铜还原为亚铁离子,过程 Ⅱ 中铜离子转化为硫化铜,过程 Ⅲ 中又生成铜离子,则铜离子、铁离子、亚铁离子均参与循环,A错误;在图示转化过程中,化合价改变的元素有O、Fe、S,共三种元素,B错误;由过程 Ⅰ 可知,O2的氧化性比Fe3+强,由过程 Ⅲ 知,Fe3+的氧化性比S强,C错误;由图可知反应 Ⅲ 为硫化铜和铁离子反应生成硫、亚铁离子和铜离子,其离子方程式为CuS+2Fe3+===S+2Fe2++Cu2+,D正确。
(2023·南京高一月考)2021年在四川广汉三星堆新发现大量青铜器,如青铜面具、青铜神树等。如图中的文物是三星堆出土的青铜面具之一,由于时间久远,表面有一层“绿锈”,“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、O2、CO2作用产生的,其化学式为Cu2(OH)2CO3,请用学过的方法对其展开探究。

(1)根据以上信息,可以获知的Cu2(OH)2CO3的物理性质有 、 (选取其中两点)。
(2)从不同的物质分类标准的角度分析,“铜绿”不属于 (填字母)。
A.铜盐 B.碳酸盐 C.碱式盐 D.碱 E.含氧酸盐
(3)从“铜绿”的组成、类别和性质的关联角度,预测它可能具有的化学性质,并用化学方程式加以表达(注:选写两个你认为可以实现的反应方程式,并且尽可能使得到的产物形态不同)
① ,
② 。
(4)以“铜绿”为反应物可以实现以下物质转化:
铜绿![]() CuCl2
CuCl2![]() Cu(OH)2
Cu(OH)2![]() CuO
CuO![]() Cu
Cu
反应④使用的是气体还原剂,且得到的产物之一可以使澄清石灰水变浑浊。请写出反应④的化学方程式: 。
答案: (1)绿色 固体 (2)D (3)Cu2(OH)2CO3 Cu2(OH)2CO3+4HCl===2CuCl2+3H2O+CO2↑ (4)CO+CuO![]() 2CuO+CO2↑+H2O
2CuO+CO2↑+H2O![]() Cu+CO2
Cu+CO2
解析:
(1)青铜面具由于时间久远,表面有一层“绿锈”,则可知Cu2(OH)2CO3的物理性质有绿色、固体。(3)Cu2(OH)2CO3属于碱式碳酸盐,化学性质不稳定,受热易分解,能和盐酸反应生成盐和水,相应的反应方程式为Cu2(OH)2CO3![]() 2CuO+CO2↑+H2O,Cu2(OH)2CO3+4HCl===2CuCl2+3H2O+CO2↑。
2CuO+CO2↑+H2O,Cu2(OH)2CO3+4HCl===2CuCl2+3H2O+CO2↑。
(2023·上海进才中学高一段考)电解质溶于水产生离子,离子之间可能发生化学反应。某兴趣小组的同学借助装置对离子在水溶液中的行为展开了一系列的探究。
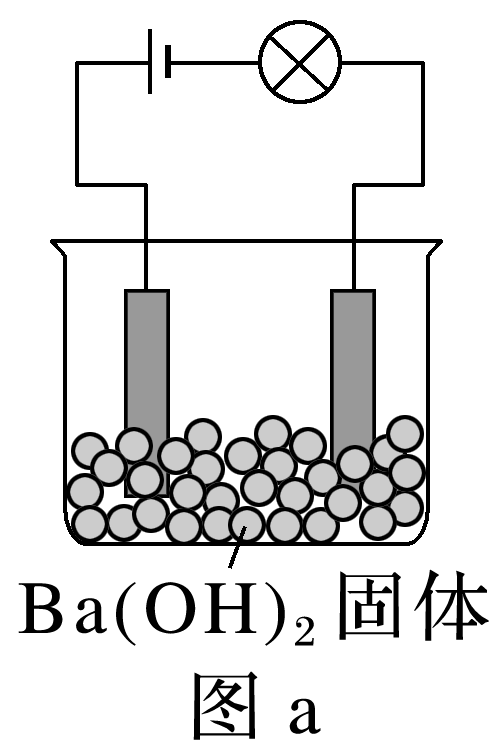
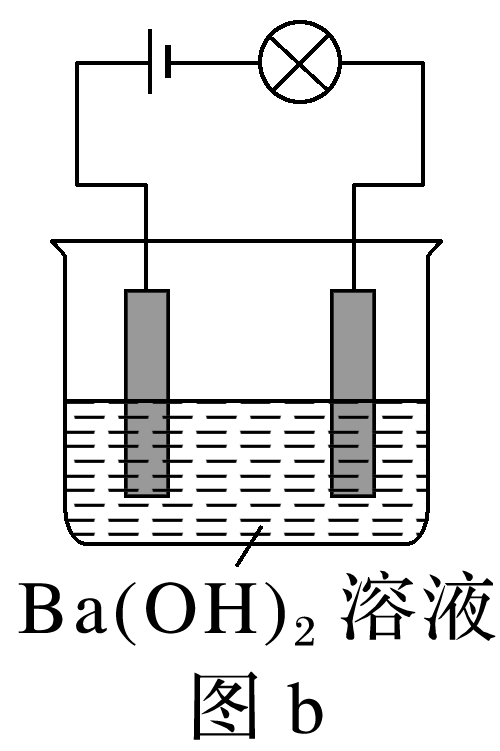
(1)该小组按照图a连接好线路后发现灯泡不亮,按照图b连接好线路后发现灯泡亮了,由此得出的结论正确的有 (填字母)。
A.Ba(OH)2固体不导电,不是电解质
B.Ba(OH)2固体只有在水溶液中才能电离出自由移动的离子
C.Ba(OH)2固体溶于水,在通电的条件下发生电离
D.电解质本身不一定能导电
(2)将以下物质:①熔融的KNO3;②氨水;③乙醇;④液氯,依次放入烧杯中。在连接好线路后,同样可以使小灯泡发光的是 。
(3)试用方程式表示出图b中主要的离子行为: 。
(4)该小组继续向盛有一定体积的Ba(OH)2溶液的图b装置中逐滴加入溶液A至过量。发现小灯泡的亮度随之逐渐变暗至熄灭,后又渐渐亮起。经分析,溶液A中可能含有的溶质是 (填字母,下同)。
A.HCl B.H2SO4
C.Na2SO4 D.NaHSO4
(5)该小组对于离子反应的认知正确的是 。
A.参加离子反应的一定都是电解质
B.任何一种离子的浓度在离子反应中一定减小
C.自由离子之间的反应不能在固体物质中进行
D.没有沉淀、气体、水生成的反应就不是离子反应
答案: (1)D (2)①② (3)Ba(OH)2===Ba2++2OH- (4)B (5)C
解析:
(1)Ba(OH)2固体不导电,但其溶于水或在熔融状态下能导电,是电解质,故选D。(2)使小灯泡发光,说明要有自由移动的带电微粒,①熔融的KNO3和②氨水中都有自由移动的离子,故①②符合题意。(4)HCl与Ba(OH)2反应生成氯化钡和水,溶液中离子浓度变化不大,灯泡亮度变化不大,A不符合题意;H2SO4与Ba(OH)2反应生成硫酸钡沉淀和水,离子浓度逐渐减小直到接近为0,灯泡变暗直到熄灭,硫酸过量时,离子浓度又逐渐增大,灯泡又逐渐变亮,故B符合题意;Ba(OH)2与Na2SO4反应生成硫酸钡沉淀和氢氧化钠,离子浓度变化不大,故C不符合题意;Ba(OH)2与NaHSO4反应生成硫酸钡沉淀、氢氧化钠和水,离子浓度不会变为0,灯泡不会熄灭,故D不符合题意。(5)活泼金属与酸的反应为离子反应,但金属不是电解质,A错误;生成物离子浓度增加,如氧化铜与酸的反应,铜离子浓度增大,B错误;固体中不存在自由移动的离子,故C正确。
(2024·陕西咸阳高一段考)饮用水安全对公众健康至关重要。
(1)自来水厂通常用明矾作净水剂,是因为它能在水中生成Al胶体,吸附水中的悬浮物。实验室区分胶体和溶液的一种常用物理方法是 。
(2)某水样中Mg2+、Ca2+、Cl-含量较多,硬度较大。“石灰—纯碱法”是软化硬水的常见方法,原理是通过离子反应将Mg2+、Ca2+转化为沉淀降低其含量。
①先向该水样中加入足量的石灰水,反应的离子方程式为 。
②再加入足量的纯碱溶液,反应的离子方程式为 。
(3)ClO2、O3是人类使用的新型自来水消毒剂。
①根据元素组成,O3和O2互为 。O3比O2具有更强的氧化性,它与KI溶液反应的化学方程式为2KI+O3+H2O===2KOH+O2+I2,用双线桥法标出该反应电子转移的方向和数目: 。
②ClO2是一种黄绿色气体,氯酸钠与足量浓盐酸在加热的条件下反应得到ClO2和Cl2的混合气体。写出该反应的化学方程式: 。
(4)高铁酸钠是一种新型绿色消毒剂,工业上制备高铁酸钠的一种方法可用离子方程式表示为ClO-+Fe3++OH-![]() +Cl-+H2O(未配平),该反应中氧化剂和还原剂的个数之比为 。
+Cl-+H2O(未配平),该反应中氧化剂和还原剂的个数之比为 。
答案: (1)丁达尔效应(或用一束光或激光笔照射待测液,产生光亮通路的是胶体,不能产生光亮通路的是溶液) (2)①Mg2++2OH-===Mg↓ ②+Ca2+===CaCO3↓ (3)①同素异形体 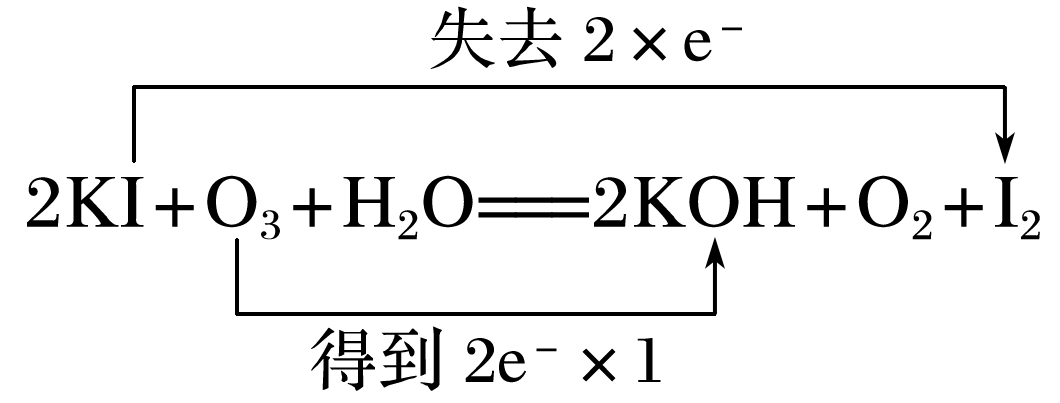 ②2NaClO3+4HCl
②2NaClO3+4HCl![]() 2NaCl+Cl2↑+2ClO2↑+2H2O (4)3∶2
2NaCl+Cl2↑+2ClO2↑+2H2O (4)3∶2
解析:
(3)①反应2KI+O3+H2O===2KOH+O2+I2中,KI化合价升高,失去电子,O3化合价降低,得到电子,双线桥法表示为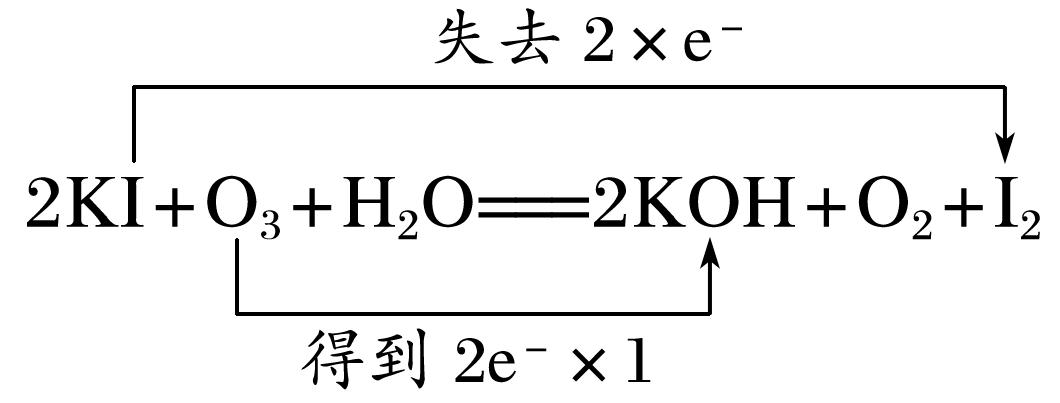 。②氯酸钠与浓盐酸反应生成ClO2和Cl2,反应的化学方程式为2NaClO3+4HCl
。②氯酸钠与浓盐酸反应生成ClO2和Cl2,反应的化学方程式为2NaClO3+4HCl![]() 2NaCl+Cl2↑+2ClO2↑+2H2O。(4)ClO-中Cl元素的化合价降低,为氧化剂,Fe3+化合价升高,为还原剂,根据得失电子守恒,其个数之比为3∶2。
2NaCl+Cl2↑+2ClO2↑+2H2O。(4)ClO-中Cl元素的化合价降低,为氧化剂,Fe3+化合价升高,为还原剂,根据得失电子守恒,其个数之比为3∶2。
某校化学兴趣小组同学猜想自来水中可能含有大量Cu2+、Ca2+、Mg2+和某些阴离子,从而进行了三组实验:
①取适量自来水于试管中,滴加足量的NaOH溶液,产生白色沉淀;
②过滤后取滤液于试管中,滴加足量的Na2CO3溶液,又有白色沉淀生成;
③另取适量自来水于试管中,滴加足量稀硝酸后再滴加AgNO3溶液,也产生白色沉淀。
请回答以下问题:
(1)不用做实验就可排除的离子是 。
(2)通过实验可初步确定自来水中 (填“含有”或“不含有”)大量Ca2+、Mg2+;判断依据的离子方程式有 。
(3)自来水中所含阴离子可以确定有 ,理由是 。
(4)确定实验②中滴加的Na2CO3溶液已过量的检验方法是 。
答案: (1)Cu2+ (2)含有 Mg2++2OH-===Mg(OH)2↓、C+Ca2+===CaCO3↓ (3)Cl- Cl-+Ag+===AgCl↓(或文字叙述),白色沉淀不溶于稀硝酸 (4)取适量实验②反应后的上层清液于试管中,滴加足量盐酸,若产生无色气泡(或滴加CaCl2溶液,若产生白色沉淀),则证明Na2CO3溶液已过量(其他合理答案也可)